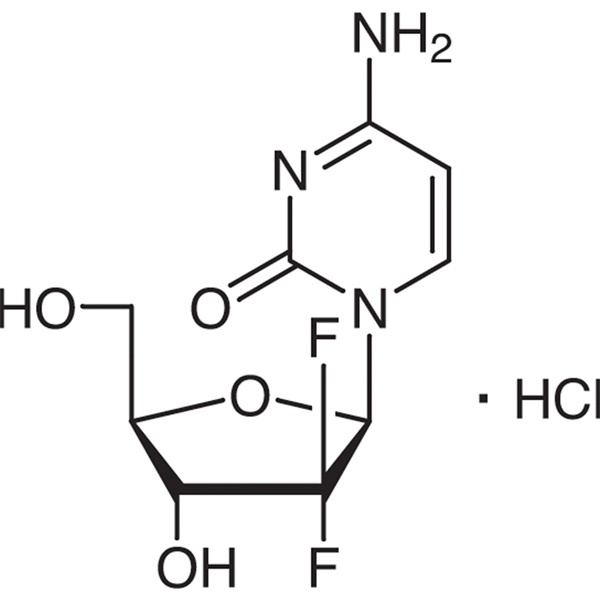
Гемцитабин хидрохлорид CAS 122111-03-9 API USP35 стандарт
Ruifu Chemical е водещият производител на гемцитабин хидрохлорид (CAS: 122111-03-9) с висококачествено търговско производство.Ruifu Chemical може да осигури доставка по целия свят, конкурентна цена, отлично обслужване, налични малки и насипни количества.Купете гемцитабин хидрохлорид,Please contact: alvin@ruifuchem.com
| Химично наименование | Гемцитабин хидрохлорид |
| Синоними | Гемцитабин НС1;2'-деокси-2',2'-дифлуороцитидин хидрохлорид;dFdC;dFdCyd;Гемзар;LY188011 Хидрохлорид;гемцитера;Гемсар |
| CAS номер | 122111-03-9 |
| Свързан CAS | 95058-81-4 - Безплатна база |
| Състояние на склад | В наличност, производствен капацитет 5 тона |
| Молекулярна формула | C9H12ClF2N3O4 |
| Молекулно тегло | 299,66 |
| Точка на топене | >250 ℃ |
| Състояние на доставка | Под температурата на околната среда |
| COA & MSDS | На разположение |
| Произход | Шанхай, Китай |
| Марка | Ruifu Chemical |
| Вещ | Спецификации | Резултати |
| Външен вид | Бял кристален прах, без мирис | Съответства |
| Разтворимост | Разтворим във вода, слабо разтворим в метанол, практически неразтворим в ацетон | Съответства |
| Идентификация IR | IR спектърът трябва да съответства на този на референтния стандарт | Съответства |
| Идентификация Хлорид | Положителен.Отговаря на изискванията на тестовете за хлорид | Съответства |
| Външен вид на разтвора | Разтвор S в бистър и не по-интензивен оцветен от референтния разтвор BY7 | Съответства |
| pH | 2,0~3,0 | 2.6 |
| Специфична ротация [α]20/D | +43,0° до +50,0° | +47,5° |
| Тежки метали (Pb) | ≤10ppm | <10 ppm |
| Загуба при сушене | ≤1,00% | 0,3% |
| Остатък при запалване | ≤0,10% | 0,03% |
| Сродни вещества | ||
| Цитозин | ≤0,10% | 0,01% |
| а-изомер | ≤0,10% | 0,01% |
| Всякакви други примеси | ≤0,10% | 0,04% |
| Общо примеси | ≤0,20% | 0,1% |
| Остатъчни разтворители | ||
| Метанол | ≤0,30% | Не е открито |
| Толуен | ≤0,01% | Не е открито |
| Дихлорометан | ≤0,01% | Не е открито |
| ацетон | ≤0,50% | 0,1% |
| Анализ | 97,5%~101,5% (изчислено на суха основа) | 99,9% |
| Заключение | Съответства на стандарта USP35 | |
Пакет:Бутилка, торба от алуминиево фолио, 25 кг / картонен барабан или според изискванията на клиента.
Условия на съхранение:Съхранявайте контейнера плътно затворен и съхранявайте на хладно, сухо и добре проветриво място, далеч от несъвместими вещества.Избягвайте излагане на пряка слънчева светлина, влага и прекомерна топлина.
Доставка:Доставяйте до цял свят по въздух, чрез FedEx / DHL Express.Осигурете бърза и надеждна доставка.


Кодове за риск R21 - Вреден при контакт с кожата
R36/38 - Дразни очите и кожата.
R46 - Може да причини наследствено генетично увреждане
R62 - Възможен риск от увреждане на плодовитостта
R63 - Възможен риск от увреждане на нероденото дете
Описание на безопасността S25 - Избягвайте контакт с очите.
S26 - При контакт с очите, изплакнете незабавно обилно с вода и потърсете медицинска помощ.
S36/37 - Носете подходящо защитно облекло и ръкавици.
S53 - Избягвайте излагане - получете специални инструкции преди употреба.
WGK Германия 3
RTECS HA3840000
Код по ХС 2942000000
Гемцитабин хидрохлорид (CAS: 122111-03-9) е ново синтетично дифлуоро нуклеозидно лекарство, което е антиметаболитно и антинеопластично.Той е проучен и разработен от Eli Lilly and Company и е одобрен да бъде включен в списъка в Южна Африка, Швеция, Холандия, Австралия и други страни през 1995 г. Американската администрация по храните и лекарствата (FDA) го одобри като терапия от първа линия за клинично лечение на недребноклетъчен рак на белия дроб и рак на панкреаса.
През последните години нови лекарства като Gemcitabine, Paclitaxel, Docetaxel, Vinorebine са ефективни лекарства за лечение на недребноклетъчен рак на белия дроб (съкратено NSCLC).В сравнение с традиционните лекарства за химиотерапия, тези лекарства имат предимствата на висок лечебен ефект и ниска токсичност.Гемцитабин хидрохлорид е ново поколение антиметаболитно лекарство и вид специално лекарство за клетъчния цикъл, играещо основна роля във фазата на синтез на ДНК, а именно S фазата на клетките.При определени условия това лекарство може да предотврати прогресията на клетките от G1 фаза към S фаза и има силно противораково действие при недребноклетъчен рак на белия дроб (NSCLC).Чуждестранни проучвания показват, че ефективността на еднократното лечение на NSCLC само с гемцитабин хидрохлорид е около 18%~35%, докато комбинираното лечение с цисплатин ефективността на NSCLC е 41,7%.При напреднал NSCLC ефективната степен на карбоплатин е 16%, което е подобно на цисплатина, но има ниска токсичност, особено за стомашно-чревни реакции, потискане на костния мозък и токсична реакция на бъбреците и нервните окончания.В комбинация с карбоплатин и двете имат взаимна координация и адитивен ефект и могат да предизвикат по-високи лечебни ефекти.
Гемцитабин хидрохлорид
C9H11F2N3O4.HCl 299.66
Цитидин, 2'-деокси-2',2'-дифлуоро-, монохидрохлорид.
2′-Деокси-2′,2′-дифлуороцитидин монохидрохлорид (β-изомер) [122111-03-9].
» Гемцитабин хидрохлорид съдържа не по-малко от 97,5 процента и не повече от 101,5 процента C9H11F2N3O4·HCl, изчислено на базата на състоянието.
[Внимание - гемцитабин хидрохлорид е мощен цитотоксичен агент.Трябва много да се внимава, за да се предотврати вдишването на частици и излагането на кожата на тях.]
Опаковка и съхранение - Да се съхранява в затворени контейнери.
Етикетиране – Когато е предназначено за използване при приготвяне на инжекционни дозирани форми, етикетът посочва, че е стерилен или трябва да бъде подложен на допълнителна обработка по време на приготвянето на инжекционни дозирани форми.
USP Референтни стандарти <11>-
USP Cytosine RS
USP Ендотоксин RS
USP гемцитабин хидрохлорид RS
Идентификация-
A: Инфрачервена абсорбция <197K>.
B: Отговаря на изискванията на тестовете за хлорид <191>.
Специфична ротация <781S>: между +43 и +50, при 20.
Тестови разтвор: 10 mg на ml.
pH <791>: между 2,0 и 3,0, в разтвор, съдържащ 10 mg на mL.
Остатък при накаляване <281>: не повече от 0,1%.
Тежки метали, Метод I <231>: 0,001%.
Хроматографска чистота-
Разтвор A- Продължете, както е указано за подвижната фаза в анализа.
Разтвор B-Пригответе филтриран и дегазиран метанол.
Подвижна фаза - Използвайте променливи смеси от разтвор А и разтвор Б, както е указано в хроматографската система.Направете корекции, ако е необходимо (вижте Пригодност на системата под Хроматография 621).
Решение за пригодност на системата - продължете, както е указано в анализа.
Стандартен разтвор – Разтворете точно претеглено количество USP гемцитабин хидрохлорид RS и USP цитозин RS във вода и разредете количествено и постепенно, ако е необходимо, за да получите разтвор с известна концентрация от около 2 µg на mL от всеки.
Тестови разтвор - Прехвърлете около 50 mg гемцитабин хидрохлорид, претеглени точно, в 25-mL мерителна колба, разтворете и разредете с вода до обема и разбъркайте.
Хроматографска система (вижте Хроматография 621) - Продължете, както е указано в Анализ.Хроматографът се програмира по следния начин.
Време (минути) Разтвор А (%) Разтвор Б (%) Елуиране
0–8 97 3 изократичен
8–13 97®50 3®50 линеен градиент
13–20 50 50 изократичен
20–25 50®97 50®3 повторно еквилибриране
Хроматографирайте разтвора за пригодност на системата и запишете пиковите отговори, както е указано за процедурата: относителните времена на задържане са около 0,5 за гемцитабин-аномер и 1,0 за гемцитабин;разделителната способност, R, между гемцитабин-аномер и гемцитабин е не по-малко от 8.0;и коефициентът на изоставане за гемцитабин е не повече от 1,5.Хроматографирайте стандартния разтвор и запишете пиковите отговори, както е указано за процедурата: относителните времена на задържане са около 0,1 за цитозин и 1,0 за гемцитабин;относителното стандартно отклонение за повторни инжекции е не повече от 2,0%.
Процедура – Отделно инжектирайте обем (около 20 µL) от стандартния разтвор и тестовия разтвор в хроматографа, запишете хроматограмата и измерете всички пикови отговори.Изчислете процента цитозин в частта гемцитабин, взета по формулата:
2,5 (Cc / W) (rt / rs)
в която Cc е концентрацията на USP Cytosine RS в стандартния разтвор, в µg на mL;W е теглото, в mg, на приетия гемцитабин;rt е пиковият отговор за цитозин в тестовия разтвор;и rs е отговорът за цитозин в стандартния разтвор: открити са не повече от 0,1% цитозин.Изчислете процента на всеки примес, различен от цитозин, в частта гемцитабин, взета по формулата:
2,5(Cs / W)(ri / rs)
в която Cs е концентрацията на USP гемцитабин хидрохлорид RS в стандартния разтвор, в µg на mL;W е теглото, в mg, на приетия гемцитабин;ri е пиковата реакция за всеки примес в тестовия разтвор;и rs е отговорът, дължащ се на гемцитабин в стандартния разтвор: не се откриват повече от 0,1% гемцитабин-аномер или друг индивидуален примес;и сумата на всички примеси е не повече от 0,2%.Изключете от сумата на всички примеси всички пикове, които са под границата на количествено определяне (0,02%).
Други изисквания – Когато на етикета е посочено, че гемцитабин хидрохлорид е стерилен, той отговаря на изискванията за бактериални ендотоксини и стерилност за гемцитабин за инжектиране.Когато на етикета е посочено, че гемцитабин хидрохлорид трябва да бъде подложен на допълнителна обработка по време на приготвянето на инжекционни лекарствени форми, той отговаря на изискванията за бактериални ендотоксини под гемцитабин за инжекции.
анализ-
Подвижна фаза - Пригответе филтриран и дегазиран разтвор, съдържащ 13,8 g моноосновен натриев фосфат и 2,5 mL фосфорна киселина в 1000 mL вода.[забележка - pH на този разтвор е между 2,4 и 2,6.]
Разтвор за пригодност на системата - Прехвърлете около 10 mg гемцитабин хидрохлорид в малък флакон, добавете 4 mL от разтвор, съдържащ 168 mg калиев хидроксид на mL метанол, затворете плътно капачката и обработете с ултразвук.Загрейте при 55°С за 6 до 16 часа, оставете да се охлади и прехвърлете съдържанието в мерителна колба от 100 ml с последователни промивания с 1% (v/v) фосфорна киселина.Разредете с 1% фосфорна киселина до обем и разбъркайте.[забележка-Този разтвор съдържа около 0,02 mg на ml гемцитабин α-аномер.]
Стандартен препарат - Разтворете точно претеглено количество USP гемцитабин хидрохлорид RS във вода и разредете количествено и постепенно, ако е необходимо, с вода, за да получите разтвор с известна концентрация от около 0,1 mg на mL.
Подготовка на анализа - Прехвърлете около 20 mg гемцитабин хидрохлорид, претеглени точно, в 200-mL мерителна колба, разтворете и разредете с вода до обем и разбъркайте.
Хроматографска система (вижте хроматография <621>) - Течният хроматограф е оборудван с 275-nm детектор и колона 4,6 mm × 25 cm, която съдържа 5-µm набивка L7.Скоростта на потока е около 1,2 ml на минута.Хроматографирайте разтвора за пригодност на системата и запишете пиковите отговори, както е указано за процедурата: разделителната способност, R, между гемцитабин-аномера и гемцитабина е не по-малка от 8,0;и коефициентът на изоставане, определен от гемцитабин, не е повече от 1,5.Хроматографирайте стандартния препарат и запишете пиковите отговори, както е указано за процедурата: относителното стандартно отклонение за повторни инжекции е не повече от 1,0%.
Процедура – Отделно инжектирайте равни обеми (около 20 µL) от стандартния препарат и препарата за анализ в хроматографа, запишете хроматограмите и измерете отговорите за основните пикове.Изчислете количеството, в mg, на C9H11F2N3O4·HCl в порцията гемцитабин хидрохлорид, взета по формулата:
200C(rU / rS)
в която C е концентрацията, в mg на ml, на USP гемцитабин хидрохлорид RS в стандартния препарат;и rU и rS са пиковите отговори, получени съответно от препарата за анализ и стандартния препарат.
-

Гемцитабин хидрохлорид CAS 122111-03-9 API U...
-

Гемцитабин CAS 95058-81-4 Анализ 98,0~102,0%
-

Цефотиам хидрохлорид CAS 66309-69-1 API USP S...
-

Доксорубицин хидрохлорид CAS 25316-40-9 API САЩ...
-

Еналаприл малеат CAS 76095-16-4 Анализ 98,0~102...
-

Гуанфацин хидрохлорид Гуанфацин HCl CAS 291...
-

Иринотекан хидрохлорид CAS 100286-90-6 Чистота...
-

Леветирацетам LEV CAS 102767-28-2 API Factory U...
-

Налтрексон хидрохлорид CAS 16676-29-2 API USP...
-

Носкапин хидрохлорид хидрат CAS 912-60-7 AP...
-

Леводопа (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Дарунавир CAS 206361-99-1 Анти-HIV чистота ≥99,0...
-

Езетимиб CAS 163222-33-1 Чистота 98,5%~102,0% (...
-

Лазофоксифен тартарат CAS 190791-29-8 Хирална пу...
-

Бортезомиб CAS 179324-69-7 Чистота ≥99,0% (HPLC)...
-

CAS 274901-16-5 Чистота ≥99,0% (HPLC) API