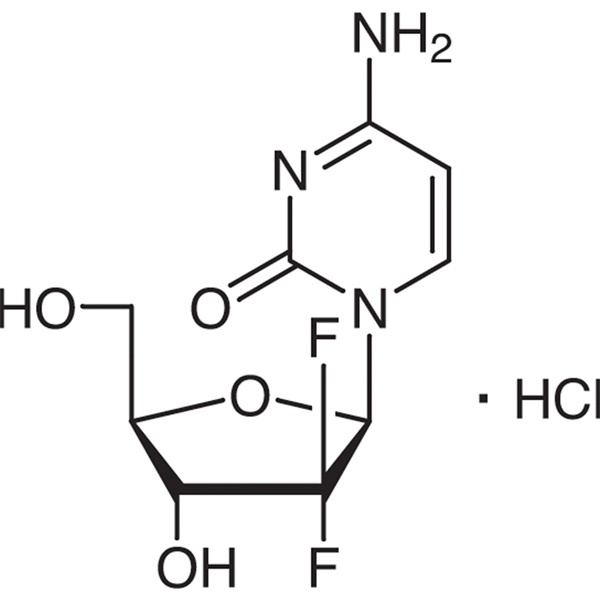
Gemcitabinhydrochlorid CAS 122111-03-9 API USP35 Standard
Ruifu Chemical ist der führende Hersteller von Gemcitabinhydrochlorid (CAS: 122111-03-9) mit hochwertiger kommerzieller Produktion.Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise, exzellenten Service sowie die Verfügbarkeit kleiner und großer Mengen.Kaufen Sie Gemcitabinhydrochlorid,Please contact: alvin@ruifuchem.com
| Chemischer Name | Gemcitabinhydrochlorid |
| Synonyme | Gemcitabin HCl;2'-Desoxy-2',2'-difluorcytidinhydrochlorid;dFdC;dFdCyd;Gemzar;LY188011 Hydrochlorid;Gemcitera;Gemsar |
| CAS-Nummer | 122111-03-9 |
| Verwandtes CAS | 95058-81-4 – Kostenlose Basis |
| Lagerbestand | Auf Lager, Produktionskapazität 5 Tonnen |
| Molekularformel | C9H12ClF2N3O4 |
| Molekulargewicht | 299,66 |
| Schmelzpunkt | >250℃ |
| Versandbedingungen | Unter Umgebungstemperatur |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft | Shanghai, China |
| Marke | Ruifu Chemical |
| Artikel | Spezifikationen | Ergebnisse |
| Aussehen | Weißes kristallines Pulver, geruchlos | Entspricht |
| Löslichkeit | Löslich in Wasser, schwer löslich in Methanol, praktisch unlöslich in Aceton | Entspricht |
| Identifikation IR | Das IR-Spektrum sollte übereinstimmen die des Referenzstandards | Entspricht |
| Identifizierung Chlorid | Positiv.Es erfüllt die Anforderungen der Tests für Chlorid | Entspricht |
| Aussehen der Lösung | Lösung S ist klar und nicht intensiver gefärbter als die Referenzlösung BY7 | Entspricht |
| pH | 2,0 ~ 3,0 | 2.6 |
| Spezifische Rotation [α]20/D | +43,0° bis +50,0° | +47,5° |
| Schwermetalle (Pb) | ≤10 ppm | <10 ppm |
| Trocknungsverlust | ≤1,00 % | 0,3 % |
| Glührückstand | ≤0,10 % | 0,03 % |
| Verwandte Substanzen | ||
| Cytosin | ≤0,10 % | 0,01 % |
| α-Isomer | ≤0,10 % | 0,01 % |
| Jede andere Verunreinigung | ≤0,10 % | 0,04 % |
| Gesamtverunreinigungen | ≤0,20 % | 0,1 % |
| Restlösungsmittel | ||
| Methanol | ≤0,30 % | Nicht erkannt |
| Toluol | ≤0,01 % | Nicht erkannt |
| Dichlormethan | ≤0,01 % | Nicht erkannt |
| Aceton | ≤0,50 % | 0,1 % |
| Test | 97,5 % ~ 101,5 % (berechnet auf getrockneter Basis) | 99,9 % |
| Abschluss | Entspricht dem USP35-Standard | |
Paket:Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel oder nach Kundenwunsch.
Lagerbedingungen:Halten Sie den Behälter fest verschlossen und lagern Sie ihn in einem kühlen, trockenen und gut belüfteten Lager, fern von unverträglichen Substanzen.Vermeiden Sie direkte Sonneneinstrahlung, Feuchtigkeit und übermäßige Hitze.
Versand:Lieferung weltweit per Luftfracht, per FedEx / DHL Express.Sorgen Sie für eine schnelle und zuverlässige Lieferung.


Risikocode R21 – Gesundheitsschädlich bei Hautkontakt
R36/38 – Reizt die Augen und die Haut.
R46 – Kann vererbbare genetische Schäden verursachen
R62 – Mögliches Risiko einer Beeinträchtigung der Fruchtbarkeit
R63 – Mögliche Gefahr einer Schädigung des ungeborenen Kindes
Sicherheitsbeschreibung S25 – Kontakt mit den Augen vermeiden.
S26 – Bei Augenkontakt sofort mit viel Wasser ausspülen und ärztlichen Rat einholen.
S36/37 - Geeignete Schutzkleidung und Handschuhe tragen.
S53 – Exposition vermeiden – vor Gebrauch besondere Anweisungen einholen.
WGK Deutschland 3
RTECS HA3840000
HS-Code 2942000000
Gemcitabinhydrochlorid (CAS: 122111-03-9) ist ein synthetisches neuartiges Difluornukleosid-Medikament, das antimetabolisch und antineoplastisch wirkt.Es wird von Eli Lilly and Company erforscht und entwickelt und wurde 1995 in Südafrika, Schweden, den Niederlanden, Australien und anderen Ländern zugelassen. Die US-amerikanische Food and Drug Administration (FDA) hat es als Erstlinientherapie zugelassen zur klinischen Behandlung von nichtkleinzelligem Lungenkrebs und Bauchspeicheldrüsenkrebs.
In den letzten Jahren sind neue Medikamente wie Gemcitabin, Paclitaxel, Docetaxel und Vinorebin wirksame Medikamente zur Behandlung von nichtkleinzelligem Lungenkrebs (abgekürzt NSCLC).Im Vergleich zu herkömmlichen Chemotherapeutika haben diese Medikamente den Vorteil einer hohen Heilwirkung und einer geringen Toxizität.Gemcitabinhydrochlorid ist ein Antimetaboliten-Medikament der neuen Generation und eine Art Spezialmedikament für den Zellzyklus, das eine wichtige Rolle in der DNA-Synthesephase, nämlich der S-Phase der Zellen, spielt.Unter bestimmten Bedingungen kann dieses Arzneimittel das Fortschreiten der Zellen von der G1-Phase in die S-Phase verhindern und eine starke krebshemmende Wirkung bei nicht-kleinzelligem Lungenkrebs (NSCLC) haben.Ausländische Studien haben gezeigt, dass die Wirksamkeit der Einzelbehandlung von NSCLC mit Gemcitabinhydrochlorid allein etwa 18–35 % beträgt, während die Wirksamkeit der Kombinationsbehandlung mit Cisplatin bei NSCLC 41,7 % beträgt.Bei fortgeschrittenem NSCLC liegt die Wirksamkeitsrate von Carboplatin bei 16 %, was Cisplatin ähnelt, aber eine geringe Toxizität aufweist, insbesondere bei gastrointestinalen Reaktionen, Knochenmarkssuppression und der toxischen Reaktion von Nieren und Nervenenden.In Kombination mit Carboplatin wirken beide gegenseitig koordinierend und additiv und können höhere Heilwirkungen erzielen.
Gemcitabinhydrochlorid
C9H11F2N3O4·HCl 299,66
Cytidin, 2′-Desoxy-2′,2′-difluor-monohydrochlorid.
2′-Desoxy-2′,2′-difluorcytidinmonohydrochlorid (β-Isomer) [122111-03-9].
» Gemcitabinhydrochlorid enthält nicht weniger als 97,5 Prozent und nicht mehr als 101,5 Prozent C9H11F2N3O4·HCl, berechnet auf der Ist-Basis.
[Achtung – Gemcitabinhydrochlorid ist ein starkes zytotoxisches Mittel.Es muss sorgfältig darauf geachtet werden, dass keine Partikel eingeatmet werden und die Haut diesen nicht ausgesetzt wird.]
Verpackung und Lagerung: In dichten Behältern aufbewahren.
Kennzeichnung: Wenn es für die Herstellung injizierbarer Dosierungsformen vorgesehen ist, gibt das Etikett an, dass es steril ist oder bei der Herstellung injizierbarer Dosierungsformen einer weiteren Verarbeitung unterzogen werden muss.
USP-Referenzstandards <11>-
USP Cytosin RS
USP Endotoxin RS
USP Gemcitabinhydrochlorid RS
Identifikation-
A: Infrarotabsorption <197K>.
B: Es erfüllt die Anforderungen der Tests für Chlorid <191>.
Spezifische Rotation <781S>: zwischen +43 und +50, bei 20.
Testlösung: 10 mg pro ml.
pH <791>: zwischen 2,0 und 3,0, in einer Lösung mit 10 mg pro ml.
Glührückstand <281>: nicht mehr als 0,1 %.
Schwermetalle, Methode I <231>: 0,001 %.
Chromatographische Reinheit –
Lösung A – Gehen Sie wie für die mobile Phase im Test beschrieben vor.
Lösung B – Bereiten Sie filtriertes und entgastes Methanol vor.
Mobile Phase: Verwenden Sie variable Mischungen von Lösung A und Lösung B, wie unter „Chromatografisches System“ beschrieben.Nehmen Sie gegebenenfalls Anpassungen vor (siehe Systemeignung unter Chromatographie 621).
Lösung zur Systemeignung: Gehen Sie wie im Test beschrieben vor.
Standardlösung – Lösen Sie eine genau abgewogene Menge USP Gemcitabinhydrochlorid RS und USP Cytosin RS in Wasser und verdünnen Sie sie quantitativ und bei Bedarf schrittweise, um eine Lösung mit einer bekannten Konzentration von jeweils etwa 2 µg pro ml zu erhalten.
Testlösung: Übertragen Sie etwa 50 mg genau abgewogenes Gemcitabinhydrochlorid in einen 25-ml-Messkolben, lösen Sie es in Wasser auf, verdünnen Sie es bis zum Volumen und mischen Sie.
Chromatographisches System (siehe Chromatographie 621) – Gehen Sie wie unter „Test“ beschrieben vor.Der Chromatograph wird wie folgt programmiert.
Zeit (Minuten) Lösung A (%) Lösung B (%) Elution
0–8 97 3 isokratisch
8–13 97®50 3®50 linearer Farbverlauf
13–20 50 50 isokratisch
20–25 50®97 50®3 Wiederherstellung des Gleichgewichts
Chromatographieren Sie die Systemeignungslösung und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die relativen Retentionszeiten betragen etwa 0,5 für Gemcitabin-Anomer und 1,0 für Gemcitabin;die Auflösung R zwischen Gemcitabin-Anomer und Gemcitabin beträgt nicht weniger als 8,0;und der Tailing-Faktor für Gemcitabin beträgt nicht mehr als 1,5.Chromatographieren Sie die Standardlösung und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die relativen Retentionszeiten betragen etwa 0,1 für Cytosin und 1,0 für Gemcitabin;Die relative Standardabweichung für Wiederholungsinjektionen beträgt nicht mehr als 2,0 %.
Verfahren: Injizieren Sie getrennt ein Volumen (ca. 20 µL) der Standardlösung und der Testlösung in den Chromatographen, zeichnen Sie das Chromatogramm auf und messen Sie alle Peak-Reaktionen.Berechnen Sie den Prozentsatz an Cytosin in der eingenommenen Portion Gemcitabin anhand der Formel:
2,5(Cc/W)(rt/rs)
wobei Cc die Konzentration von USP Cytosin RS in der Standardlösung in µg pro ml ist;W ist das Gewicht des eingenommenen Gemcitabin in mg;rt ist die Spitzenreaktion für Cytosin in der Testlösung;und rs ist die Reaktion für Cytosin in der Standardlösung: Es werden nicht mehr als 0,1 % Cytosin gefunden.Berechnen Sie den Prozentsatz jeder anderen Verunreinigung als Cytosin in der Gemcitabin-Menge anhand der Formel:
2,5(Cs / W)(ri / rs)
wobei Cs die Konzentration von USP Gemcitabinhydrochlorid RS in der Standardlösung in µg pro ml ist;W ist das Gewicht des eingenommenen Gemcitabin in mg;ri ist die Spitzenreaktion für jede Verunreinigung in der Testlösung;und rs ist die Reaktion aufgrund von Gemcitabin in der Standardlösung: Es wurden nicht mehr als 0,1 % Gemcitabin-Anomer oder eine andere einzelne Verunreinigung gefunden;und die Summe aller Verunreinigungen beträgt nicht mehr als 0,2 %.Aus der Summe aller Verunreinigungen sind alle Peaks auszuschließen, die unterhalb der Bestimmungsgrenze (0,02 %) liegen.
Weitere Anforderungen: Wenn auf dem Etikett angegeben ist, dass Gemcitabinhydrochlorid steril ist, erfüllt es die Anforderungen für bakterielle Endotoxine und Sterilität gemäß Gemcitabin zur Injektion.Wenn auf dem Etikett angegeben ist, dass Gemcitabinhydrochlorid bei der Herstellung injizierbarer Darreichungsformen einer weiteren Verarbeitung unterzogen werden muss, erfüllt es die Anforderungen für bakterielle Endotoxine gemäß Gemcitabin zur Injektion.
Assay-
Mobile Phase: Bereiten Sie eine filtrierte und entgaste Lösung vor, die 13,8 g einbasiges Natriumphosphat und 2,5 ml Phosphorsäure in 1000 ml Wasser enthält.[Hinweis: Der pH-Wert dieser Lösung liegt zwischen 2,4 und 2,6.]
Lösung zur Systemeignung: Übertragen Sie etwa 10 mg Gemcitabinhydrochlorid in ein kleines Fläschchen, geben Sie 4 ml einer Lösung mit 168 mg Kaliumhydroxid pro ml Methanol hinzu, verschließen Sie es fest und behandeln Sie es mit Ultraschall.6 bis 16 Stunden lang auf 55 °C erhitzen, abkühlen lassen und den Inhalt in einen 100-ml-Messkolben überführen und nacheinander mit 1 %iger (v/v) Phosphorsäure waschen.Mit 1 %iger Phosphorsäure auf das Volumen verdünnen und mischen.[Hinweis: Diese Lösung enthält etwa 0,02 mg pro ml Gemcitabin-α-Anomer.]
Standardzubereitung – Lösen Sie eine genau abgewogene Menge USP Gemcitabinhydrochlorid RS in Wasser und verdünnen Sie es quantitativ und bei Bedarf schrittweise mit Wasser, um eine Lösung mit einer bekannten Konzentration von etwa 0,1 mg pro ml zu erhalten.
Testvorbereitung: Etwa 20 mg genau abgewogenes Gemcitabinhydrochlorid in einen 200-ml-Messkolben überführen, in Wasser auflösen und mit Wasser auf das Volumen verdünnen und mischen.
Chromatografisches System (siehe Chromatographie <621>) – Der Flüssigkeitschromatograph ist mit einem 275-nm-Detektor und einer 4,6 mm × 25 cm großen Säule ausgestattet, die eine 5-µm-Packung L7 enthält.Die Flussrate beträgt etwa 1,2 ml pro Minute.Chromatographieren Sie die Systemeignungslösung und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die Auflösung R zwischen dem Gemcitabin-Anomer und Gemcitabin beträgt nicht weniger als 8,0;und der aus Gemcitabin ermittelte Tailing-Faktor beträgt nicht mehr als 1,5.Chromatographieren Sie das Standardpräparat und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die relative Standardabweichung für Wiederholungsinjektionen beträgt nicht mehr als 1,0 %.
Verfahren: Injizieren Sie getrennt gleiche Volumina (ca. 20 µL) der Standardzubereitung und der Testzubereitung in den Chromatographen, zeichnen Sie die Chromatogramme auf und messen Sie die Reaktionen für die Hauptpeaks.Berechnen Sie die Menge (in mg) an C9H11F2N3O4·HCl in der Portion Gemcitabinhydrochlorid anhand der Formel:
200 °C (rU / rS)
wobei C die Konzentration von USP Gemcitabinhydrochlorid RS in der Standardzubereitung in mg pro ml ist;und rU und rS sind die Spitzenreaktionen, die mit der Testvorbereitung bzw. der Standardvorbereitung erhalten wurden.
-

Gemcitabinhydrochlorid CAS 122111-03-9 API U...
-

Gemcitabin CAS 95058-81-4 Test 98,0~102,0 %
-

Cefotiamhydrochlorid CAS 66309-69-1 API USP S...
-

Doxorubicinhydrochlorid CAS 25316-40-9 API US...
-

Enalaprilmaleat CAS 76095-16-4 Assay 98,0~102...
-

Guanfacinhydrochlorid Guanfacin HCl CAS 291...
-

Irinotecanhydrochlorid CAS 100286-90-6 Reinheit...
-

Levetiracetam LEV CAS 102767-28-2 API Factory U...
-

Naltrexonhydrochlorid CAS 16676-29-2 API USP...
-

Noscapinhydrochloridhydrat CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0~100,5 % USP B...
-

Darunavir CAS 206361-99-1 Anti-HIV Reinheit ≥99,0...
-

Ezetimib CAS 163222-33-1 Reinheit 98,5 % ~ 102,0 % (...
-

Lasofoxifentartrat CAS 190791-29-8 Chiral Pu...
-

Bortezomib CAS 179324-69-7 Reinheit ≥99,0 % (HPLC)...
-

CAS 274901-16-5 Reinheit ≥99,0 % (HPLC) API