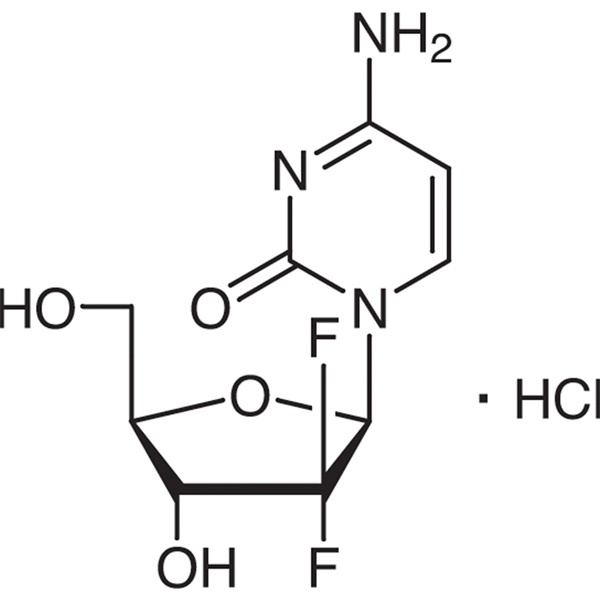
Gemcitabine Hydrochloride CAS 122111-03-9 API USP35 Standard
Η Ruifu Chemical είναι ο κορυφαίος κατασκευαστής υδροχλωρικής γεμσιταβίνης (CAS: 122111-03-9) με υψηλής ποιότητας, εμπορική παραγωγή.Η Ruifu Chemical μπορεί να προσφέρει παγκόσμια παράδοση, ανταγωνιστική τιμή, εξαιρετική εξυπηρέτηση, μικρές και χύμα διαθέσιμες ποσότητες.Αγοράστε υδροχλωρική γεμσιταβίνη,Please contact: alvin@ruifuchem.com
| Χημική ονομασία | Υδροχλωρική γεμσιταβίνη |
| Συνώνυμα | Γεμσιταβίνη HCl;Υδροχλωρική 2'-Δεοξυ-2',2'-Διφθοροκυτιδίνη.dFdC;dFdCyd;Gemzar;Υδροχλωρικό LY188011;Gemcitera;Gemsar |
| Αριθμός CAS | 122111-03-9 |
| Σχετικό CAS | 95058-81-4 - Δωρεάν βάση |
| Κατάσταση μετοχής | Σε απόθεμα, Παραγωγική Δυνατότητα 5 Τόνων |
| Μοριακός τύπος | C9H12ClF2N3O4 |
| Μοριακό βάρος | 299,66 |
| Σημείο τήξης | >250℃ |
| Κατάσταση Αποστολής | Κάτω από τη θερμοκρασία περιβάλλοντος |
| COA & MSDS | Διαθέσιμος |
| Προέλευση | Σανγκάη, Κίνα |
| Μάρκα | Ruifu Chemical |
| Είδος | Προδιαγραφές | Αποτελέσματα |
| Εμφάνιση | Λευκή κρυσταλλική σκόνη, άοσμη | Συμμορφώνεται |
| Διαλυτότητα | Διαλυτό στο νερό, ελαφρώς διαλυτό σε μεθανόλη, πρακτικά αδιάλυτο στην ακετόνη | Συμμορφώνεται |
| Ταυτοποίηση IR | Το φάσμα IR πρέπει να είναι σύμφωνο με του προτύπου αναφοράς | Συμμορφώνεται |
| Αναγνώριση Χλωριούχο | Θετικός.Πληροί τις απαιτήσεις των δοκιμών για χλωρίδιο | Συμμορφώνεται |
| Εμφάνιση Λύσης | Λύση Σ σε σαφή και όχι πιο έντονα έγχρωμο από το διάλυμα αναφοράς BY7 | Συμμορφώνεται |
| pH | 2,0~3,0 | 2.6 |
| Ειδική Περιστροφή [α]20/D | +43,0° έως +50,0° | +47,5° |
| Βαρέα μέταλλα (Pb) | ≤10 ppm | <10 ppm |
| Απώλεια στο στέγνωμα | ≤1,00% | 0,3% |
| Υπολείμματα κατά την ανάφλεξη | ≤0,10% | 0,03% |
| Σχετικές Ουσίες | ||
| Κυτοσίνη | ≤0,10% | 0,01% |
| α-ισομερές | ≤0,10% | 0,01% |
| Οποιαδήποτε άλλη ακαθαρσία | ≤0,10% | 0,04% |
| Ολικές προσμίξεις | ≤0,20% | 0,1% |
| Υπολειμματικοί Διαλύτες | ||
| Μεθανόλη | ≤0,30% | Δεν εντοπίστηκε |
| Τολουΐνη | ≤0,01% | Δεν εντοπίστηκε |
| Διχλωρομεθάνιο | ≤0,01% | Δεν εντοπίστηκε |
| Ακετόνη | ≤0,50% | 0,1% |
| Χημική δοκιμή | 97,5%~101,5% (Υπολογιζόμενο σε αποξηραμένη βάση) | 99,9% |
| συμπέρασμα | Συμμορφώνεται με το πρότυπο USP35 | |
Πακέτο:Μπουκάλι, τσάντα από αλουμινόχαρτο, 25kg/Τύμπανο από χαρτόνι ή σύμφωνα με την απαίτηση του πελάτη.
Συνθήκη αποθήκευσης:Διατηρείτε το δοχείο ερμητικά κλειστό και αποθηκεύστε το σε μια δροσερή, ξηρή και καλά αεριζόμενη αποθήκη μακριά από ασυμβίβαστες ουσίες.Αποφύγετε την έκθεση στο άμεσο ηλιακό φως, την υγρασία και την υπερβολική ζέστη.
Αποστολή:Παράδοση σε όλο τον κόσμο αεροπορικώς, με FedEx / DHL Express.Παρέχετε γρήγορη και αξιόπιστη παράδοση.


Κωδικοί κινδύνου R21 - Επιβλαβές σε επαφή με το δέρμα
R36/38 - Ερεθίζει τα μάτια και το δέρμα.
R46 - Μπορεί να προκαλέσει κληρονομική γενετική βλάβη
R62 - Πιθανός κίνδυνος μειωμένης γονιμότητας
R63 - Πιθανός κίνδυνος βλάβης στο αγέννητο παιδί
Περιγραφή ασφαλείας S25 - Αποφύγετε την επαφή με τα μάτια.
S26 - Σε περίπτωση επαφής με τα μάτια, ξεπλύνετε αμέσως με άφθονο νερό και ζητήστε ιατρική συμβουλή.
S36/37 - Φοράτε κατάλληλη προστατευτική ενδυμασία και γάντια.
S53 - Αποφύγετε την έκθεση - λάβετε ειδικές οδηγίες πριν από τη χρήση.
WGK Γερμανία 3
RTECS HA3840000
Κωδικός HS 2942000000
Το Gemcitabine Hydrochloride (CAS: 122111-03-9) είναι ένα νέο συνθετικό φάρμακο διφθορονουκλεοζίτη που είναι αντιμεταβολικό και αντινεοπλασματικό.Ερευνήθηκε και αναπτύχθηκε από την Eli Lilly and Company και εγκρίθηκε για να εισαχθεί στη Νότια Αφρική, τη Σουηδία, την Ολλανδία, την Αυστραλία και άλλες χώρες το 1995. Ο Οργανισμός Τροφίμων και Φαρμάκων των Ηνωμένων Πολιτειών (FDA) το ενέκρινε ως θεραπεία πρώτης γραμμής για την κλινική θεραπεία του μη μικροκυτταρικού καρκίνου του πνεύμονα και του καρκίνου του παγκρέατος.
Τα τελευταία χρόνια, νέα φάρμακα όπως Gemcitabine, Paclitaxel, Docetaxel, Vinorebine είναι αποτελεσματικά φάρμακα για τη θεραπεία του μη μικροκυτταρικού καρκίνου του πνεύμονα (συντομογραφία NSCLC).Σε σύγκριση με τα παραδοσιακά φάρμακα χημειοθεραπείας, αυτά τα φάρμακα έχουν τα πλεονεκτήματα της υψηλής θεραπευτικής δράσης και της χαμηλής τοξικότητας.Το Gemcitabine Hydrochloride είναι μια νέα γενιά φαρμάκου κατά των μεταβολιτών και ένας τύπος ειδικού φαρμάκου για τον κυτταρικό κύκλο, που παίζει σημαντικό ρόλο στη φάση σύνθεσης του DNA, δηλαδή στη φάση S των κυττάρων.Κάτω από ορισμένες συνθήκες, αυτό το φάρμακο μπορεί να αποτρέψει την εξέλιξη των κυττάρων από τη φάση G1 στη φάση S και να έχει ισχυρή αντικαρκινική δράση μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC).Ξένες μελέτες έχουν δείξει ότι η αποτελεσματικότητα της μεμονωμένης θεραπείας για το ΜΜΚΠ μόνο με υδροχλωρική γεμσιταβίνη είναι περίπου 18%~35%, ενώ σε συνδυασμό η θεραπεία με σισπλατίνη η αποτελεσματικότητα για το ΜΜΚΠ είναι 41,7%.Στο προχωρημένο ΜΜΚΠ, το αποτελεσματικό ποσοστό της καρβοπλατίνης είναι 16%, το οποίο είναι παρόμοιο με τη σισπλατίνη, αλλά έχει χαμηλή τοξικότητα, ειδικά για γαστρεντερικές αντιδράσεις, καταστολή του μυελού των οστών και την τοξική αντίδραση των νεφρών και των νευρικών απολήξεων.Σε συνδυασμό με την καρβοπλατίνη, και οι δύο έχουν αμοιβαίο συντονισμό και αθροιστική δράση και μπορούν να παράγουν υψηλότερα θεραπευτικά αποτελέσματα.
Υδροχλωρική γεμσιταβίνη
C9H11F2N3O4·HCl 299,66
Κυτιδίνη, 2'-δεοξυ-2', 2'-διφθορο-, μονοϋδροχλωρική.
Μονοϋδροχλωρική 2'-δεοξυ-2',2'-διφθοροκυτιδίνη (β-ισομερές) [122111-03-9].
» Το Gemcitabine Hydrochloride περιέχει τουλάχιστον 97,5 τοις εκατό και όχι περισσότερο από 101,5 τοις εκατό C9H11F2N3O4·HCl, υπολογιζόμενο ως έχει.
[Προσοχή-Η υδροχλωρική γεμσιταβίνη είναι ένας ισχυρός κυτταροτοξικός παράγοντας.Θα πρέπει να δίνεται μεγάλη προσοχή για να αποφευχθεί η εισπνοή σωματιδίων και η έκθεση του δέρματος σε αυτά.]
Συσκευασία και αποθήκευση-Διατήρηση σε σφιχτά δοχεία.
Επισήμανση-Όταν προορίζεται για χρήση στην παρασκευή ενέσιμων μορφών δοσολογίας, η ετικέτα αναφέρει ότι είναι αποστειρωμένο ή πρέπει να υποβληθεί σε περαιτέρω επεξεργασία κατά την παρασκευή ενέσιμων δοσολογικών μορφών.
Πρότυπα αναφοράς USP <11>-
USP Cytosine RS
USP Ενδοτοξίνη RS
USP Gemcitabine Hydrochloride RS
Ταυτοποίηση-
Α: Απορρόφηση υπερύθρων <197K>.
Β: Πληροί τις απαιτήσεις των δοκιμών για Χλώριο <191>.
Ειδική περιστροφή <781S>: μεταξύ +43 και +50, στο 20.
Διάλυμα δοκιμής: 10 mg ανά mL.
pH <791>: μεταξύ 2,0 και 3,0, σε διάλυμα που περιέχει 10 mg ανά mL.
Υπόλειμμα κατά την ανάφλεξη <281>: όχι περισσότερο από 0,1%.
Βαρέα μέταλλα, Μέθοδος Ι <231>: 0,001%.
Χρωματογραφική καθαρότητα-
Λύση Α- Προχωρήστε σύμφωνα με τις οδηγίες για τη φάση κινητής στον προσδιορισμό.
Διάλυμα Β-Προετοιμάστε διηθημένη και απαερωμένη μεθανόλη.
Κινητή φάση-Χρησιμοποιήστε μεταβλητά μείγματα του διαλύματος Α και του διαλύματος Β σύμφωνα με τις οδηγίες στο Χρωματογραφικό σύστημα.Κάντε προσαρμογές, εάν είναι απαραίτητο (βλ. Καταλληλότητα συστήματος στην ενότητα Χρωματογραφία 621).
Λύση καταλληλότητας συστήματος-Συνεχίστε όπως υποδεικνύεται στην Ανάλυση.
Πρότυπο διάλυμα-Διαλύστε μια επακριβώς ζυγισμένη ποσότητα USP Gemcitabine Hydrochloride RS και USP Cytosine RS σε νερό και αραιώστε ποσοτικά και σταδιακά εάν χρειάζεται, για να λάβετε ένα διάλυμα με γνωστή συγκέντρωση περίπου 2 μg ανά mL του καθενός.
Δοκιμαστικό διάλυμα-Μεταφέρετε περίπου 50 mg υδροχλωρικής γεμσιταβίνης, ζυγισμένη με ακρίβεια, σε ογκομετρική φιάλη 25 mL, διαλύστε και αραιώστε με νερό μέχρι όγκου και αναμίξτε.
Χρωματογραφικό σύστημα (βλ. Χρωματογραφία 621)-Συνεχίστε σύμφωνα με τις οδηγίες στο Δοκιμασία.Ο χρωματογράφος προγραμματίζεται ως εξής.
Χρόνος (λεπτά) Διάλυμα Α (%) Διάλυμα Β (%) Έκλουση
0–8 97 3 ισοκρατικός
8–13 97®50 3®50 γραμμική κλίση
13–20 50 50 ισοκρατικός
20–25 50®97 50®3 επανισορρόπηση
Χρωματογραφήστε το διάλυμα καταλληλότητας συστήματος και καταγράψτε τις αποκρίσεις αιχμής σύμφωνα με τις οδηγίες για τη Διαδικασία: οι σχετικοί χρόνοι κατακράτησης είναι περίπου 0,5 για το ανωμερές γεμσιταβίνη και 1,0 για τη γεμσιταβίνη.η ανάλυση, R, μεταξύ ανωμερούς γεμσιταβίνης και γεμσιταβίνης δεν είναι μικρότερη από 8,0.και ο παράγοντας ουράς για τη γεμσιταβίνη δεν είναι μεγαλύτερος από 1,5.Χρωματογραφήστε το Πρότυπο διάλυμα και καταγράψτε τις αποκρίσεις κορυφής σύμφωνα με τις οδηγίες για τη Διαδικασία: οι σχετικοί χρόνοι κατακράτησης είναι περίπου 0,1 για την κυτοσίνη και 1,0 για τη γεμσιταβίνη.η σχετική τυπική απόκλιση για επαναλαμβανόμενες ενέσεις δεν είναι μεγαλύτερη από 2,0%.
Διαδικασία-Εγχύστε χωριστά έναν όγκο (περίπου 20 µL) του Πρότυπου διαλύματος και του διαλύματος δοκιμής στον χρωματογράφο, καταγράψτε το χρωματογράφημα και μετρήστε όλες τις αποκρίσεις κορυφής.Υπολογίστε το ποσοστό της κυτοσίνης στο τμήμα της γεμσιταβίνης που λαμβάνεται με τον τύπο:
2,5 (Cc / W) (rt / rs)
στο οποίο Cc είναι η συγκέντρωση της USP Κυτοσίνης RS στο Πρότυπο διάλυμα, σε μg ανά mL.W είναι το βάρος, σε mg, της γεμσιταβίνης που λαμβάνεται.rt είναι η απόκριση κορυφής για κυτοσίνη στο διάλυμα δοκιμής.και rs είναι η απόκριση για κυτοσίνη στο Πρότυπο διάλυμα: δεν βρίσκεται περισσότερο από 0,1% κυτοσίνης.Υπολογίστε το ποσοστό κάθε ακαθαρσίας εκτός της κυτοσίνης στο τμήμα της γεμσιταβίνης που λαμβάνεται με τον τύπο:
2,5(Cs / W) (ri / rs)
στο οποίο Cs είναι η συγκέντρωση του USP Gemcitabine Hydrochloride RS στο Πρότυπο διάλυμα, σε μg ανά mL.W είναι το βάρος, σε mg, της γεμσιταβίνης που λαμβάνεται.Το ri είναι η απόκριση κορυφής για κάθε ακαθαρσία στο διάλυμα δοκιμής.και rs είναι η απόκριση που οφείλεται στη γεμσιταβίνη στο Πρότυπο διάλυμα: δεν βρέθηκε περισσότερο από 0,1% ανωμερούς γεμσιταβίνης ή οποιαδήποτε άλλη μεμονωμένη ακαθαρσία.και το άθροισμα όλων των ακαθαρσιών δεν είναι μεγαλύτερο από 0,2%.Εξαιρέστε από το άθροισμα όλων των προσμείξεων οποιεσδήποτε κορυφές είναι κάτω από το όριο ποσοτικοποίησης (0,02%).
Άλλες απαιτήσεις-Όπου η ετικέτα αναφέρει ότι το Gemcitabine Hydrochloride είναι στείρο, πληροί τις απαιτήσεις για Βακτηριακές ενδοτοξίνες και Στειρότητα στο Gemcitabine for Injection.Όταν η ετικέτα αναφέρει ότι το Gemcitabine Hydrochloride πρέπει να υποβληθεί σε περαιτέρω επεξεργασία κατά την παρασκευή ενέσιμων δοσολογικών μορφών, πληροί τις απαιτήσεις για Βακτηριακές ενδοτοξίνες στο Gemcitabine for Injection.
Χημική δοκιμή-
Κινητή φάση-Παρασκευάστε ένα διηθημένο και απαερωμένο διάλυμα που περιέχει 13,8 g μονοβασικού φωσφορικού νατρίου και 2,5 mL φωσφορικού οξέος σε 1000 mL νερού.[σημείωση-Το pH αυτού του διαλύματος είναι μεταξύ 2,4 και 2,6.]
Διάλυμα καταλληλότητας συστήματος-Μεταφέρετε περίπου 10 mg υδροχλωρικής γεμσιταβίνης σε ένα μικρό φιαλίδιο, προσθέστε 4 mL διαλύματος που περιέχει 168 mg υδροξειδίου του καλίου ανά mL μεθανόλης, καλύψτε καλά και υποβάλετε σε υπερήχους.Θερμάνετε στους 55°C για 6 έως 16 ώρες, αφήστε το να κρυώσει και μεταφέρετε το περιεχόμενο σε ογκομετρική φιάλη 100 mL με διαδοχικές πλύσεις φωσφορικού οξέος 1% (v/v).Αραιώνεται με 1% φωσφορικό οξύ μέχρι τον όγκο και αναμειγνύεται.[σημείωση-Αυτό το διάλυμα περιέχει περίπου 0,02 mg ανά mL α-ανωμερούς γεμσιταβίνης.]
Τυπικό παρασκεύασμα-Διαλύστε μια επακριβώς ζυγισμένη ποσότητα USP Gemcitabine Hydrochloride RS σε νερό και αραιώστε ποσοτικά, και σταδιακά εάν χρειάζεται, με νερό για να λάβετε ένα διάλυμα με γνωστή συγκέντρωση περίπου 0,1 mg ανά mL.
Προετοιμασία ανάλυσης-Μεταφέρετε περίπου 20 mg υδροχλωρικής γεμσιταβίνης, ζυγισμένη με ακρίβεια, σε ογκομετρική φιάλη 200 mL, διαλύστε και αραιώστε με νερό μέχρι όγκου και αναμίξτε.
Χρωματογραφικό σύστημα (βλ. Χρωματογραφία <621>)-Ο υγρός χρωματογράφος είναι εξοπλισμένος με έναν ανιχνευτή 275 nm και μια στήλη 4,6 mm × 25 cm που περιέχει συσκευασία L7 5 μm.Ο ρυθμός ροής είναι περίπου 1,2 mL ανά λεπτό.Χρωματογραφήστε το διάλυμα καταλληλότητας συστήματος και καταγράψτε τις αποκρίσεις κορυφής σύμφωνα με τις οδηγίες για τη Διαδικασία: η ανάλυση, R, μεταξύ του ανωμερούς γεμσιταβίνης και της γεμσιταβίνης δεν είναι μικρότερη από 8,0.και ο παράγοντας ουράς που προσδιορίζεται από τη γεμσιταβίνη δεν είναι μεγαλύτερος από 1,5.Χρωματογραφήστε το Πρότυπο παρασκεύασμα και καταγράψτε τις αποκρίσεις κορυφής σύμφωνα με τις οδηγίες για τη Διαδικασία: η σχετική τυπική απόκλιση για επαναλαμβανόμενες ενέσεις δεν είναι μεγαλύτερη από 1,0%.
Διαδικασία-Εγχύστε χωριστά ίσους όγκους (περίπου 20 µL) του Πρότυπου παρασκευάσματος και του παρασκευάσματος της δοκιμασίας στον χρωματογράφο, καταγράψτε τα χρωματογραφήματα και μετρήστε τις αποκρίσεις για τις κύριες κορυφές.Υπολογίστε την ποσότητα, σε mg, του C9H11F2N3O4·HCl στο τμήμα της υδροχλωρικής γεμσιταβίνης που λαμβάνεται με τον τύπο:
200C (rU / rS)
στην οποία C είναι η συγκέντρωση, σε mg ανά mL, του USP Gemcitabine Hydrochloride RS στο Πρότυπο παρασκεύασμα.και rU και rS είναι οι αποκρίσεις κορυφής που λαμβάνονται από το παρασκεύασμα της δοκιμασίας και το πρότυπο παρασκεύασμα, αντίστοιχα.
-

Gemcitabine Hydrochloride CAS 122111-03-9 API U...
-

Gemcitabine CAS 95058-81-4 Δοκιμασία 98,0~102,0%
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Doxorubicin Hydrochloride CAS 25316-40-9 API US...
-

Δοκιμασία μηλεϊνικής εναλαπρίλης CAS 76095-16-4 98.0~102...
-

Guanfacine Hydrochloride Guanfacine HCl CAS 291...
-

Irinotecan Hydrochloride CAS 100286-90-6 Purity...
-

Levetiracetam LEV CAS 102767-28-2 API Factory U...
-

Naltrexone Hydrochloride CAS 16676-29-2 API USP...
-

Noscapine Hydrochloride Hydrate CAS 912-60-7 AP...
-

Λεβοντόπα (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Darunavir CAS 206361-99-1 Anti-HIV Καθαρότητα ≥99,0...
-

Ezetimibe CAS 163222-33-1 Καθαρότητα 98,5%~102,0% (...
-

Lasofoxifene Tartrate CAS 190791-29-8 Chiral Pu...
-

Bortezomib CAS 179324-69-7 Καθαρότητα ≥99,0% (HPLC)...
-

CAS 274901-16-5 Purity ≥99,0% (HPLC) API