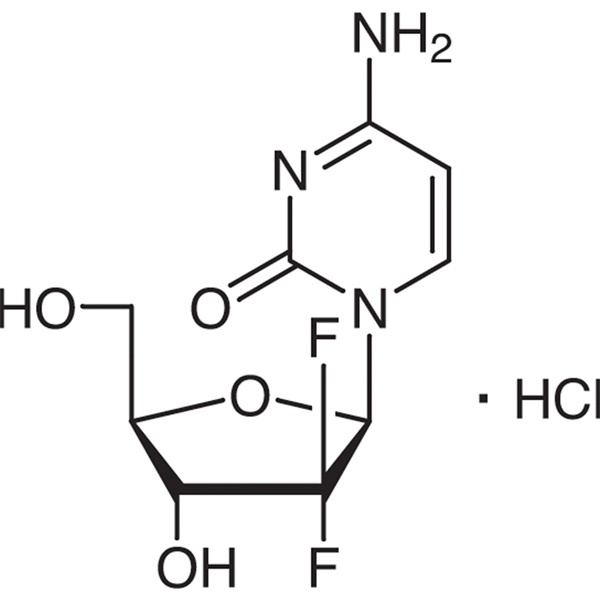
Clorhidrato de gemcitabina CAS 122111-03-9 Estándar API USP35
Ruifu Chemical es el fabricante líder de clorhidrato de gemcitabina (CAS: 122111-03-9) con producción comercial de alta calidad.Ruifu Chemical puede proporcionar entregas en todo el mundo, precios competitivos, excelente servicio, cantidades pequeñas y al por mayor disponibles.Comprar clorhidrato de gemcitabina,Please contact: alvin@ruifuchem.com
| Nombre químico | clorhidrato de gemcitabina |
| Sinónimos | clorhidrato de gemcitabina;clorhidrato de 2'-desoxi-2',2'-difluorocitidina;dFdC;dFdCyd;Gemzar;LY188011 Clorhidrato;gemcítera;Gemsar |
| Número CAS | 122111-03-9 |
| NAC relacionados | 95058-81-4 - Base libre |
| Estado del inventario | En Stock, Capacidad de Producción 5 Toneladas |
| Fórmula molecular | C9H12ClF2N3O4 |
| Peso molecular | 299.66 |
| Punto de fusion | >250℃ |
| Condición de envío | Bajo temperatura ambiente |
| COA y MSDS | Disponible |
| Origen | Shanghai, China |
| Marca | Química Ruifu |
| Artículo | Especificaciones | Resultados |
| Apariencia | Polvo cristalino blanco, inodoro | Cumple |
| Solubilidad | Soluble en agua, ligeramente soluble en metanol, prácticamente insoluble en acetona | Cumple |
| Identificación IR | El espectro IR debe ser concordante con la del patrón de referencia | Cumple |
| Cloruro de identificación | Positivo.Cumple con los requisitos de las pruebas de cloruro. | Cumple |
| Aspecto de la solución | Solución S en claro y no más intensamente coloreado que la solución de referencia BY7 | Cumple |
| pH | 2,0~3,0 | 2.6 |
| Rotación específica [α]20/D | +43,0° a +50,0° | +47,5° |
| Metales Pesados (Pb) | ≤10 ppm | <10 ppm |
| Pérdida por secado | ≤1.00% | 0,3% |
| Residuos en ignición | ≤0.10% | 0,03% |
| Sustancias relacionadas | ||
| Citosina | ≤0.10% | 0.01% |
| isómero α | ≤0.10% | 0.01% |
| Cualquier otra impureza | ≤0.10% | 0,04% |
| impurezas totales | ≤0.20% | 0,1% |
| Solventes residuales | ||
| metanol | ≤0.30% | No detectado |
| tolueno | ≤0.01% | No detectado |
| diclorometano | ≤0.01% | No detectado |
| Acetona | ≤0.50% | 0,1% |
| Ensayo | 97,5 %~101,5 % (calculado en base seca) | 99,9% |
| Conclusión | Cumple con el estándar USP35 | |
Paquete:Botella, bolsa de papel de aluminio, tambor de 25 kg/cartón, o según los requisitos del cliente.
Condición de almacenamiento:Mantenga el recipiente bien cerrado y guárdelo en un almacén fresco, seco y bien ventilado, lejos de sustancias incompatibles.Evite la exposición a la luz solar directa, la humedad y el calor excesivo.
Envío:Envíe a todo el mundo por aire, por FedEx / DHL Express.Proporcione una entrega rápida y confiable.


Códigos de riesgo R21 - Nocivo en contacto con la piel
R36/38 - Irrita los ojos y la piel.
R46 - Puede causar daño genético hereditario
R62 - Posible riesgo de alteración de la fertilidad
R63 - Posible riesgo de daño al feto
Descripción de seguridad S25 - Evítese el contacto con los ojos.
S26 - En caso de contacto con los ojos, lávense inmediata y abundantemente con agua y acúdase a un médico.
S36/37 - Úsense indumentaria y guantes de protección adecuados.
S53 - Evítese la exposición - recábense instrucciones especiales antes del uso.
WGK Alemania 3
RTEC HA3840000
Código SA 2942000000
El clorhidrato de gemcitabina (CAS: 122111-03-9) es un nuevo fármaco difluoronucleósido sintético que es antimetabólico y antineoplásico.Es investigado y desarrollado por Eli Lilly and Company y aprobado para ser incluido en Sudáfrica, Suecia, los Países Bajos, Australia y otros países en 1995. La Administración de Drogas y Alimentos de los Estados Unidos (FDA) lo aprobó como la terapia de primera línea. para el tratamiento clínico del cáncer de pulmón de células no pequeñas y el cáncer de páncreas.
En los últimos años, nuevos medicamentos como Gemcitabina, Paclitaxel, Docetaxel, Vinorebina son medicamentos efectivos para el tratamiento del cáncer de pulmón de células no pequeñas (CPNM abreviado).En comparación con los medicamentos de quimioterapia tradicionales, estos medicamentos tienen las ventajas de un alto efecto curativo y una baja toxicidad.El clorhidrato de gemcitabina es una nueva generación de medicamentos antimetabolitos y un tipo de medicamento especial para el ciclo celular, que desempeña un papel importante en la fase de síntesis de ADN, es decir, la fase S de las células.Bajo ciertas condiciones, este medicamento puede prevenir la progresión de las células de la fase G1 a la fase S y tener una fuerte actividad anticancerígena en el cáncer de pulmón de células no pequeñas (NSCLC).Estudios extranjeros han demostrado que la eficiencia del tratamiento único para NSCLC con clorhidrato de gemcitabina es de aproximadamente 18 % ~ 35 %, mientras que el tratamiento combinado con cisplatino la eficiencia para NSCLC es de 41,7 %.En el NSCLC avanzado, la tasa efectiva de carboplatino es del 16%, que es similar al cisplatino, pero tiene baja toxicidad, especialmente para las reacciones gastrointestinales, la supresión de la médula ósea y la reacción tóxica de los riñones y las terminaciones nerviosas.En combinación con carboplatino, ambos tienen una coordinación mutua y un efecto aditivo, y pueden producir efectos curativos más altos.
clorhidrato de gemcitabina
C9H11F2N3O4·HCl 299,66
Citidina, 2′-desoxi-2′,2′-difluoro-, monoclorhidrato.
Monoclorhidrato de 2′-desoxi-2′,2′-difluorocitidina (isómero β) [122111-03-9].
» El clorhidrato de gemcitabina contiene no menos del 97,5 por ciento y no más del 101,5 por ciento de C9H11F2N3O4·HCl, calculado tal como está.
[Precaución: el clorhidrato de gemcitabina es un agente citotóxico potente.Se debe tener mucho cuidado para evitar inhalar partículas y exponer la piel a ellas.]
Envasado y almacenamiento-Conservar en recipientes herméticos.
Etiquetado: cuando esté destinado a usarse en la preparación de formas de dosificación inyectables, la etiqueta indica que es estéril o debe someterse a un procesamiento adicional durante la preparación de las formas de dosificación inyectables.
Normas de referencia USP <11>-
ER Citosina USP
ER Endotoxina USP
ER Clorhidrato de Gemcitabina USP
Identificación-
A: Absorción de infrarrojos <197K>.
B: Cumple con los requisitos de las pruebas de Cloruro <191>.
Rotación específica <781S>: entre +43 y +50, a las 20.
Solución de prueba: 10 mg por ml.
pH <791>: entre 2,0 y 3,0, en una solución que contenga 10 mg por mL.
Residuo de ignición <281>: no más del 0,1 %.
Metales pesados, Método I <231>: 0,001%.
Pureza cromatográfica-
Solución A: proceda como se indica para la fase móvil en el ensayo.
Solución B-Preparar metanol filtrado y desgasificado.
Fase móvil: use mezclas variables de Solución A y Solución B como se indica en Sistema cromatográfico.Realice ajustes, si es necesario (consulte Idoneidad del sistema en Cromatografía 621).
Solución de idoneidad del sistema: proceda como se indica en la Valoración.
Solución estándar: disolver una cantidad pesada con precisión de ER Clorhidrato de Gemcitabina USP y ER Citosina USP en agua y diluir cuantitativamente, y por etapas si es necesario, para obtener una solución con una concentración conocida de aproximadamente 2 µg por mL de cada uno.
Solución de prueba: transferir aproximadamente 50 mg de clorhidrato de gemcitabina, pesados con precisión, a un matraz volumétrico de 25 ml, disolver y diluir a volumen con agua y mezclar.
Sistema cromatográfico (consulte Cromatografía 621): proceda como se indica en Valoración.El cromatógrafo se programa de la siguiente manera.
Tiempo (minutos) Solución A (%) Solución B (%) Elución
0–8 97 3 isocrático
8–13 97®50 3®50 gradiente lineal
13–20 50 50 isocrático
20–25 50®97 50®3 reequilibrio
Cromatografíe la Solución de aptitud del sistema y registre las respuestas máximas como se indica en el Procedimiento: los tiempos de retención relativos son aproximadamente 0,5 para el anómero de gemcitabina y 1,0 para la gemcitabina;la resolución, R, entre el anómero de gemcitabina y la gemcitabina no es inferior a 8,0;y el factor de cola para la gemcitabina no es superior a 1,5.Cromatografíe la Solución estándar y registre las respuestas de los picos como se indica en el Procedimiento: los tiempos de retención relativos son aproximadamente 0,1 para la citosina y 1,0 para la gemcitabina;la desviación estándar relativa para las inyecciones repetidas no es superior al 2,0 %.
Procedimiento: inyecte por separado un volumen (alrededor de 20 µL) de la Solución estándar y la Solución de prueba en el cromatógrafo, registre el cromatograma y mida todas las respuestas de los picos.Calcular el porcentaje de citosina en la porción de Gemcitabina tomada por la fórmula:
2.5 (Cc / W) (rt / rs)
donde Cc es la concentración de ER Citosina USP en la Solución estándar, en µg por mL;W es el peso, en mg, de gemcitabina ingerida;rt es la respuesta máxima de citosina en la Solución de prueba;y rs es la respuesta para citosina en la Solución estándar: no se encuentra más del 0,1 % de citosina.Calcular el porcentaje de cada impureza que no sea citosina en la porción de Gemcitabina tomada por la fórmula:
2.5 (Cs / W) (ri / rs)
donde Cs es la concentración de ER Clorhidrato de Gemcitabina USP en la Solución estándar, en µg por mL;W es el peso, en mg, de gemcitabina ingerida;ri es la respuesta máxima para cada impureza en la Solución de prueba;y rs es la respuesta debida a gemcitabina en la Solución estándar: no se encuentra más del 0,1 % de anómero de gemcitabina o cualquier otra impureza individual;y la suma de todas las impurezas no supera el 0,2%.Excluya de la suma de todas las impurezas cualquier pico que esté por debajo del límite de cuantificación (0,02 %).
Otros requisitos: cuando la etiqueta indica que el clorhidrato de gemcitabina es estéril, cumple con los requisitos de endotoxinas bacterianas y esterilidad de gemcitabina inyectable.Cuando la etiqueta indica que el clorhidrato de gemcitabina debe someterse a un procesamiento adicional durante la preparación de las formas de dosificación inyectables, cumple con los requisitos para las endotoxinas bacterianas según Gemcitabina para inyección.
Ensayo-
Fase móvil-Preparar una solución filtrada y desgasificada que contenga 13,8 g de fosfato monobásico de sodio y 2,5 mL de ácido fosfórico en 1000 mL de agua.[nota: el pH de esta solución está entre 2,4 y 2,6.]
Solución de aptitud del sistema: transfiera aproximadamente 10 mg de clorhidrato de gemcitabina a un vial pequeño, agregue 4 ml de una solución que contenga 168 mg de hidróxido de potasio por ml de metanol, tápelo herméticamente y someta a ultrasonidos.Calentar a 55ºC durante 6 a 16 horas, dejar enfriar y transferir el contenido a un matraz aforado de 100 mL con lavados sucesivos de ácido fosfórico al 1% (v/v).Diluir con ácido fosfórico al 1% a volumen y mezclar.[nota: esta solución contiene alrededor de 0,02 mg por ml de anómero α de gemcitabina.]
Preparación estándar: disolver en agua una cantidad pesada con precisión de ER Clorhidrato de Gemcitabina USP y diluir cuantitativamente, y por etapas si es necesario, con agua para obtener una solución que tenga una concentración conocida de aproximadamente 0,1 mg por mL.
Preparación de valoración: transferir aproximadamente 20 mg de clorhidrato de gemcitabina, pesados con precisión, a un matraz volumétrico de 200 ml, disolver y diluir a volumen con agua y mezclar.
Sistema cromatográfico (consulte Cromatografía <621>): el cromatógrafo de líquidos está equipado con un detector de 275 nm y una columna de 4,6 mm × 25 cm que contiene un relleno L7 de 5 µm.El caudal es de aproximadamente 1,2 ml por minuto.Cromatografíe la solución de idoneidad del sistema y registre las respuestas máximas como se indica en el Procedimiento: la resolución, R, entre el anómero de gemcitabina y la gemcitabina no es inferior a 8,0;y el factor de cola determinado a partir de gemcitabina no es superior a 1,5.Cromatografíe la preparación estándar y registre las respuestas de los picos como se indica en el Procedimiento: la desviación estándar relativa para las inyecciones repetidas no es superior al 1,0 %.
Procedimiento: inyecte por separado volúmenes iguales (alrededor de 20 µL) de la Preparación estándar y la Preparación de valoración en el cromatógrafo, registre los cromatogramas y mida las respuestas de los picos principales.Calcular la cantidad, en mg, de C9H11F2N3O4·HCl en la porción de Clorhidrato de Gemcitabina tomada por la fórmula:
200C (rU / rS)
donde C es la concentración, en mg por mL, de ER Clorhidrato de Gemcitabina USP en la Preparación estándar;y rU y rS son las respuestas máximas obtenidas de la Preparación de valoración y la Preparación estándar, respectivamente.
-

Clorhidrato de gemcitabina CAS 122111-03-9 API U...
-

Gemcitabina CAS 95058-81-4 Ensayo 98.0~102.0%
-

Clorhidrato de cefotiam CAS 66309-69-1 API USP S...
-

Clorhidrato de doxorrubicina CAS 25316-40-9 API US ...
-

Maleato de enalapril CAS 76095-16-4 Ensayo 98.0 ~ 102 ...
-

Clorhidrato de guanfacina Guanfacina HCl CAS 291...
-

Clorhidrato de irinotecán CAS 100286-90-6 Pureza...
-

Levetiracetam LEV CAS 102767-28-2 API Fábrica U ...
-

Clorhidrato de naltrexona CAS 16676-29-2 API USP...
-

Hidrato de clorhidrato de noscapina CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99.0~100.5% USP B...
-

Darunavir CAS 206361-99-1 Anti-VIH Pureza ≥99.0...
-

Ezetimiba CAS 163222-33-1 Pureza 98.5%~102.0% (...
-

Tartrato de lasofoxifeno CAS 190791-29-8 Pu quiral...
-

Bortezomib CAS 179324-69-7 Pureza ≥99.0% (HPLC)...
-

CAS 274901-16-5 Pureza ≥99,0 % (HPLC) API