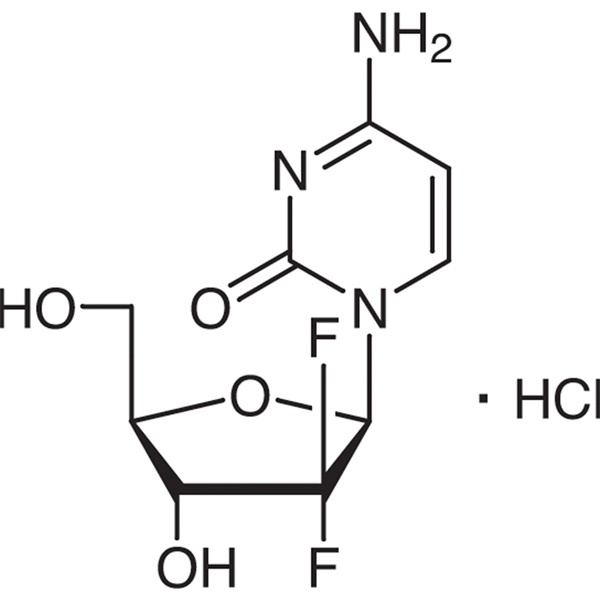
Gemtsitabiinvesinikkloriid CAS 122111-03-9 API USP35 standard
Ruifu Chemical on gemtsitabiinvesinikkloriidi (CAS: 122111-03-9) juhtiv kõrge kvaliteediga kaubandusliku tootmise tootja.Ruifu Chemical võib pakkuda ülemaailmset tarnimist, konkurentsivõimelist hinda, suurepärast teenindust, väikeseid ja hulgi koguseid.Ostke gemtsitabiinvesinikkloriidi,Please contact: alvin@ruifuchem.com
| Keemiline nimetus | Gemtsitabiinvesinikkloriid |
| Sünonüümid | Gemtsitabiin HCl;2'-desoksü-2',2'-difluorotsütidiinvesinikkloriid;dFdC;dFdCyd;Gemzar;LY188011 vesinikkloriid;Gemcitera;Gemsar |
| CAS number | 122111-03-9 |
| Seotud CAS | 95058-81-4 – vaba alus |
| Laoseis | Laos, tootmisvõimsus 5 tonni |
| Molekulaarvalem | C9H12ClF2N3O4 |
| Molekulmass | 299,66 |
| Sulamispunkt | >250 ℃ |
| Saatmise seisukord | Toatemperatuuri all |
| COA ja MSDS | Saadaval |
| Päritolu | Shanghai, Hiina |
| Bränd | Ruifu keemia |
| Üksus | Tehnilised andmed | Tulemused |
| Välimus | Valge kristalne pulber, lõhnatu | Vastab |
| Lahustuvus | Vees lahustuv, metanoolis veidi lahustuv, atsetoonis praktiliselt lahustumatu | Vastab |
| Identifikatsioon IR | IR-spekter peaks olema kooskõlas etalonstandardi oma | Vastab |
| Identifitseerimine Kloriid | Positiivne.See vastab kloriidikatsete nõuetele | Vastab |
| Lahuse välimus | Lahendus S on selge ja mitte intensiivsem värvunud kui võrdluslahus BY7 | Vastab |
| pH | 2,0-3,0 | 2.6 |
| Eripööre [a]20/D | +43,0° kuni +50,0° | +47,5° |
| Raskmetallid (Pb) | ≤10 ppm | <10 ppm |
| Kaod kuivamisel | ≤1,00% | 0,3% |
| Jäägid süttimisel | ≤0,10% | 0,03% |
| Seotud ained | ||
| Tsütosiin | ≤0,10% | 0,01% |
| α-isomeer | ≤0,10% | 0,01% |
| Igasugune muu lisand | ≤0,10% | 0,04% |
| Lisandid kokku | ≤0,20% | 0,1% |
| Lahustite jäägid | ||
| metanool | ≤0,30% | Ei tuvastatud |
| Tolueen | ≤0,01% | Ei tuvastatud |
| diklorometaan | ≤0,01% | Ei tuvastatud |
| Atsetoon | ≤0,50% | 0,1% |
| Analüüs | 97,5% ~ 101,5% (arvutatud kuivatatud alusel) | 99,9% |
| Järeldus | Vastab USP35 standardile | |
Pakett:Pudel, alumiiniumfooliumist kott, 25 kg / papptrummel või vastavalt kliendi soovile.
Säilitamise seisukord:Hoida konteiner tihedalt suletuna ja hoida jahedas, kuivas ja hästi ventileeritavas laos, eemal kokkusobimatutest ainetest.Vältige kokkupuudet otsese päikesevalguse, niiskuse ja liigse kuumusega.
Kohaletoimetamine:Tarnige FedExi / DHL Expressi kaudu õhutranspordiga kogu maailmas.Pakkuge kiiret ja usaldusväärset kohaletoimetamist.


Riskikoodid R21 – Kahjulik kokkupuutel nahaga
R36/38 - Ärritab silmi ja nahka.
R46 - Võib põhjustada pärilikke geneetilisi kahjustusi
R62 - Võimalik viljakuse kahjustamise oht
R63 - Võimalik kahjustada sündimata last
Ohutuskirjeldus S25 - Vältida silma sattumist.
S26 - Silma sattumisel loputada koheselt rohke veega ja pöörduda arsti poole.
S36/37 - Kanda sobivat kaitseriietust ja -kindaid.
S53 – Vältida kokkupuudet – tutvuda enne kasutamist erijuhistega.
WGK Saksamaa 3
RTECS HA3840000
HS kood 2942000000
Gemtsitabiinvesinikkloriid (CAS: 122111-03-9) on sünteetiline uudne difluoronukleosiidravim, mis on metaboolne ja kasvajavastane.Seda uuris ja arendas Eli Lilly and Company ning see on 1995. aastal heaks kiidetud Lõuna-Aafrikas, Rootsis, Hollandis, Austraalias ja teistes riikides. Ameerika Ühendriikide Toidu- ja Ravimiamet (FDA) kiitis selle heaks esmavaliku ravimina. mitteväikerakk-kopsuvähi ja kõhunäärmevähi kliiniliseks raviks.
Viimastel aastatel on uued ravimid, nagu gemtsitabiin, paklitakseel, dotsetakseel, vinorebiin, tõhusad ravimid mitteväikerakk-kopsuvähi (lühendatult NSCLC) raviks.Võrreldes traditsiooniliste keemiaravi ravimitega on nende ravimite eeliseks kõrge ravitoime ja madal toksilisus.Gemcitabine Hydrochloride on uue põlvkonna metaboliitide vastane ravim ja teatud tüüpi spetsiaalne ravim rakutsükli jaoks, mis mängib olulist rolli DNA sünteesi faasis, nimelt rakkude S-faasis.Teatud tingimustel võib see ravim takistada rakkude progresseerumist G1-faasist S-faasi ja omada tugevat vähivastast toimet mitteväikerakk-kopsuvähi (NSCLC) puhul.Välismaised uuringud on näidanud, et NSCLC ühekordse ravi efektiivsus ainult gemtsitabiinvesinikkloriidiga on umbes 18–35%, samas kui kombineeritud ravi tsisplatiiniga on NSCLC efektiivsus 41,7%.Kaugelearenenud NSCLC korral on karboplatiini efektiivne määr 16%, mis on sarnane tsisplatiiniga, kuid on madala toksilisusega, eriti seedetrakti reaktsioonide, luuüdi supressiooni ning neerude ja närvilõpmete toksilise reaktsiooni korral.Kombinatsioonis karboplatiiniga on neil mõlemal vastastikune koordineeriv ja aditiivne toime ning neil võib olla suurem ravitoime.
Gemtsitabiinvesinikkloriid
C9H11F2N3O4·HCl 299,66
Tsütidiin, 2'-desoksü-2',2'-difluoro-, monovesinikkloriid.
2'-desoksü-2',2'-difluorotsütidiini monovesinikkloriid (β-isomeer) [122111-03-9].
» Gemtsitabiinvesinikkloriid sisaldab mitte vähem kui 97,5 protsenti ja mitte rohkem kui 101,5 protsenti C9H11F2N3O4·HCl, arvutatuna praegusel kujul.
[Ettevaatust – gemtsitabiinvesinikkloriid on tugev tsütotoksiline aine.Tuleb olla väga ettevaatlik, et vältida osakeste sissehingamist ja naha kokkupuudet sellega.]
Pakendamine ja ladustamine - Säilitada tihedalt suletud pakendites.
Märgistamine – kui see on ette nähtud kasutamiseks süstitavate ravimvormide valmistamisel, märgitakse etiketil, et see on steriilne või seda tuleb süstitavate ravimvormide valmistamise ajal täiendavalt töödelda.
USP viitestandardid <11>-
USP Cytosine RS
USP Endotoksiin RS
USP Gemcitabine Hydrochloride RS
Identifitseerimine-
V: Infrapuna neeldumine <197K>.
B: see vastab kloriidi <191> testide nõuetele.
Eripööre <781S>: vahemikus +43 kuni +50, temperatuuril 20.
Uuritav lahus: 10 mg/ml.
pH <791>: vahemikus 2,0 kuni 3,0, lahuses, mis sisaldab 10 mg/ml.
Süttimisjääk <281>: mitte üle 0,1%.
Raskmetallid, I meetod <231>: 0,001%.
Kromatograafiline puhtus -
Lahendus A – toimige nii, nagu on kirjeldatud testi mobiilse faasi jaoks.
Lahus B – Valmistage filtreeritud ja degaseeritud metanool.
Liikuv faas – kasutage lahuse A ja lahuse B muutuvaid segusid vastavalt kromatograafilise süsteemi juhistele.Vajadusel tehke muudatusi (vt Süsteemi sobivus jaotises Chromatography 621).
Süsteemi sobivuse lahendus – jätkake testis kirjeldatud viisil.
Standardlahus – lahustage täpselt kaalutud kogus USP Gemcitabine Hydrochloride RS-i ja USP Cytosine RS-i vees ning lahjendage kvantitatiivselt ja vajadusel järk-järgult, et saada lahus, mille teadaolev kontsentratsioon on umbes 2 µg kummagi ml kohta.
Katselahus. Viige umbes 50 mg täpselt kaalutud gemtsitabiinvesinikkloriidi 25-mL mõõtekolbi, lahustage ja lahjendage veega mahuni ning segage.
Kromatograafiline süsteem (vt kromatograafia 621) – jätkake nagu on kirjeldatud jaotises Katse.Kromatograaf on programmeeritud järgmiselt.
Aeg (minutid) Lahus A (%) Lahus B (%) Elueerimine
0–8 97 3 isokraatlik
8–13 97®50 3®50 lineaarne gradient
13–20 50 50 isokraatlik
20–25 50®97 50®3 uuesti tasakaalustamine
Kromatografeerige süsteemi sobivuse lahus ja registreerige maksimaalsed vastused vastavalt protseduurile: suhtelised retentsiooniajad on umbes 0,5 gemtsitabiini anomeeri ja 1,0 gemtsitabiini puhul;eraldusvõime R gemtsitabiini anomeeri ja gemtsitabiini vahel ei ole väiksem kui 8,0;ja gemtsitabiini jääktegur ei ole suurem kui 1,5.Kromatografeerige standardlahus ja registreerige maksimaalsed vastused vastavalt protseduurile: suhtelised retentsiooniajad on umbes 0,1 tsütosiini ja 1,0 gemtsitabiini puhul;kordussüstide suhteline standardhälve ei ole suurem kui 2,0%.
Protseduur – süstige kromatograafi eraldi kogus (umbes 20 µL) standardlahust ja testlahust, registreerige kromatogramm ja mõõtke kõik piikide vastused.Arvutage tsütosiini protsent gemtsitabiini portsjonis järgmise valemiga:
2,5 (Cc / W) (rt / rs)
milles Cc on USP tsütosiini RS kontsentratsioon standardlahuses µg/ml;W on võetud gemtsitabiini kaal milligrammides;rt on tsütosiini maksimaalne reaktsioon katselahuses;ja rs on vastus tsütosiinile standardlahuses: tsütosiini ei leita rohkem kui 0,1%.Arvutage kõigi lisandite (va tsütosiini) protsent gemtsitabiini osas järgmise valemiga:
2,5 (Cs / W) (ri / rs)
milles Cs on USP Gemcitabine Hydrochloride RS kontsentratsioon standardlahuses, µg/ml;W on võetud gemtsitabiini kaal milligrammides;ri on testlahuse iga lisandi maksimaalne reaktsioon;ja rs on vastus, mis tuleneb gemtsitabiinist standardlahuses: ei leitud rohkem kui 0,1% gemtsitabiini anomeeri või mõnda muud individuaalset lisandit;ja kõigi lisandite summa ei ületa 0,2%.Kõikide lisandite summast jäetakse välja kõik piigid, mis jäävad alla kvantifitseerimispiiri (0,02%).
Muud nõuded – kui etiketil on kirjas, et Gemcitabine Hydrochloride on steriilne, vastab see gemtsitabiini süstimiseks ettenähtud bakteriaalsete endotoksiinide ja steriilsuse nõuetele.Kui etiketil on kirjas, et süstitavate ravimvormide valmistamisel tuleb gemtsitabiinvesinikkloriidi täiendavalt töödelda, vastab see gemtsitabiini süstimiseks mõeldud bakteriaalsete endotoksiinide nõuetele.
Analüüs-
Liikuv faas – valmistage filtreeritud ja degaseeritud lahus, mis sisaldab 13,8 g ühealuselist naatriumfosfaati ja 2,5 ml fosforhapet 1000 ml vees.[märkus – selle lahuse pH on 2,4 ja 2,6 vahel.]
Süsteemi sobivuslahus – kandke umbes 10 mg gemtsitabiinvesinikkloriidi väikesesse viaali, lisage 4 ml lahust, mis sisaldab 168 mg kaaliumhüdroksiidi ml metanooli kohta, sulgege tihedalt kork ja töödelge ultraheliga.Kuumutage temperatuuril 55 °C 6–16 tundi, laske jahtuda ja viige sisu 100-mL mõõtekolbi, pestes järjestikku 1% (maht/maht) fosforhappega.Lahjendage 1% fosforhappega mahuni ja segage.[Märkus. See lahus sisaldab umbes 0,02 mg gemtsitabiini α-anomeeri ml kohta.]
Standardpreparaat – lahustage täpselt kaalutud kogus USP Gemcitabine Hydrochloride RS-i vees ja lahjendage kvantitatiivselt ja vajadusel järk-järgult veega, et saada lahus, mille teadaolev kontsentratsioon on umbes 0,1 mg/ml.
Analüüsi ettevalmistamine – Viige umbes 20 mg täpselt kaalutud gemtsitabiinvesinikkloriidi 200-mL mõõtekolbi, lahustage ja lahjendage veega mahuni ning segage.
Kromatograafiasüsteem (vt Kromatograafia <621>) – vedelikkromatograaf on varustatud 275 nm detektoriga ja 4,6 mm × 25 cm kolonniga, mis sisaldab 5 µm täiteainet L7.Voolukiirus on umbes 1,2 ml minutis.Kromatografeerige süsteemi sobivuse lahus ja registreerige maksimaalsed vastused vastavalt protseduurile: eraldusvõime R gemtsitabiini anomeeri ja gemtsitabiini vahel ei ole väiksem kui 8,0;ja gemtsitabiini põhjal määratud sabategur ei ole suurem kui 1,5.Kromatografeerige standardpreparaat ja registreerige maksimaalsed vastused vastavalt protseduurile: suhteline standardhälve korduvate süstide korral ei ole suurem kui 1,0%.
Protseduur – süstige kromatograafi eraldi võrdsed mahud (umbes 20 µL) standardpreparaati ja analüüsipreparaati, registreerige kromatogrammid ja mõõtke peamiste piikide vastuseid.Arvutage C9H11F2N3O4·HCl kogus milligrammides gemtsitabiinvesinikkloriidi osas järgmise valemiga:
200C (rU / rS)
milles C on USP Gemcitabine Hydrochloride RS kontsentratsioon (mg/ml) standardpreparaadis;ning rU ja rS on vastavalt katsepreparaadist ja standardpreparaadist saadud vastused.
-

Gemcitabine Hydrochloride CAS 122111-03-9 API U...
-

Gemtsitabiini CAS 95058-81-4 test 98,0–102,0%
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Doxorubicin Hydrochloride CAS 25316-40-9 API USA...
-

Enalapriilmaleaat CAS 76095-16-4 analüüs 98,0-102...
-

Guanfatsiini vesinikkloriid Guanfatsiini HCl CAS 291...
-

Irinotekaanvesinikkloriid CAS 100286-90-6 Puhtus...
-

Levetiratsetaam LEV CAS 102767-28-2 API Factory U...
-

Naltreksoonvesinikkloriid CAS 16676-29-2 API USP...
-

Noskapiinvesinikkloriidhüdraat CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0–100,5% USP B...
-

Darunaviir CAS 206361-99-1 HIV-vastane puhtus ≥99,0...
-

Esetimibe CAS 163222-33-1 Puhtus 98,5% ~ 102,0% (...
-

Lasofoksifeentartraat CAS 190791-29-8 Kiraalne Pu...
-

Bortesomiib CAS 179324-69-7 Puhtus ≥99,0% (HPLC)...
-

CAS 274901-16-5 Puhtus ≥99,0% (HPLC) API