Gemsitabiinihydrokloridi CAS 122111-03-9 API USP35 -standardi
Ruifu Chemical on johtava gemsitabiinihydrokloridin (CAS: 122111-03-9) valmistaja korkealaatuisella kaupallisella tuotannolla.Ruifu Chemical voi tarjota maailmanlaajuisen toimituksen, kilpailukykyisen hinnan, erinomaisen palvelun, pieniä ja suuria määriä saatavilla.Osta gemsitabiinihydrokloridi,Please contact: alvin@ruifuchem.com
| Kemiallinen nimi | Gemsitabiinihydrokloridi |
| Synonyymit | gemsitabiini-HCl;2'-deoksi-2',2'-difluorosytidiinihydrokloridi;dFdC;dFdCyd;Gemzar;LY188011 Hydrokloridi;Gemcitera;Gemsar |
| CAS-numero | 122111-03-9 |
| Asiaan liittyvä CAS | 95058-81-4 - vapaa tukikohta |
| Varaston tila | Varastossa, tuotantokapasiteetti 5 tonnia |
| Molekyylikaava | C9H12ClF2N3O4 |
| Molekyylipaino | 299,66 |
| Sulamispiste | >250 ℃ |
| Toimituksen kunto | Ympäristön lämpötilan alla |
| Aitoustodistus ja käyttöturvallisuustiedote | Saatavilla |
| Alkuperä | Shanghai, Kiina |
| Brändi | Ruifu Chemical |
| Tuote | Tekniset tiedot | Tulokset |
| Ulkomuoto | Valkoinen kiteinen jauhe, hajuton | Täyttää |
| Liukoisuus | Liukenee veteen, liukenee heikosti metanoliin, käytännössä liukenematon asetoniin | Täyttää |
| Tunnistus IR | IR-spektrin tulee olla yhdenmukainen että viitestandardin | Täyttää |
| Tunnistus Chloride | Positiivista.Se täyttää kloriditestien vaatimukset | Täyttää |
| Ratkaisun ulkonäkö | Ratkaisu S on kirkas eikä voimakkaampi värillinen kuin vertailuliuos BY7 | Täyttää |
| pH | 2,0-3,0 | 2.6 |
| Ominaiskierto [a]20/D | +43,0° - +50,0° | +47,5° |
| Raskasmetallit (Pb) | ≤10 ppm | <10 ppm |
| Kuivaushäviö | ≤1,00 % | 0,3 % |
| Jäännös syttyessä | ≤0,10 % | 0,03 % |
| Samankaltaiset aineet | ||
| Sytosiini | ≤0,10 % | 0,01 % |
| α-isomeeri | ≤0,10 % | 0,01 % |
| Mikä tahansa muu epäpuhtaus | ≤0,10 % | 0,04 % |
| Epäpuhtaudet yhteensä | ≤0,20 % | 0,1 % |
| Liuotinjäämät | ||
| Metanoli | ≤0,30 % | Ei havaittu |
| Tolueeni | ≤0,01 % | Ei havaittu |
| dikloorimetaani | ≤0,01 % | Ei havaittu |
| Asetoni | ≤0,50 % | 0,1 % |
| Määritys | 97,5 % ~ 101,5 % (laskettuna kuivatusta pohjasta) | 99,9 % |
| Johtopäätös | Täyttää USP35 standardin | |
Paketti:Pullo, alumiinifoliopussi, 25 kg / pahvirumpu tai asiakkaan vaatimuksen mukaan.
Säilytysolosuhteet:Pidä säiliö tiiviisti suljettuna ja säilytä viileässä, kuivassa ja hyvin ilmastoidussa varastossa erillään yhteensopimattomista aineista.Vältä altistumista suoralle auringonvalolle, kosteudelle ja liialliselle kuumuudelle.
Laivaus:Toimitus maailmanlaajuisesti lentoteitse FedEx / DHL Expressin kautta.Tarjoa nopea ja luotettava toimitus.


Riskikoodit R21 - Haitallista joutuessaan iholle
R36/38 - Ärsyttää silmiä ja ihoa.
R46 - Saattaa aiheuttaa periytyviä geneettisiä vaurioita
R62 - Mahdollinen hedelmällisyyden heikkenemisen vaara
R63 - Mahdollinen vaara sikiölle
Turvallisuusseloste S25 - Varottava kemikaalin joutumista silmiin.
S26 - Roiskeet silmistä huuhdeltava välittömästi runsaalla vedellä ja mentävä lääkäriin.
S36/37 - Käytä sopivaa suojavaatetusta ja suojakäsineitä.
S53 - Vältä altistumista - hanki erityisohjeet ennen käyttöä.
WGK Saksa 3
RTECS HA3840000
HS-koodi 2942000000
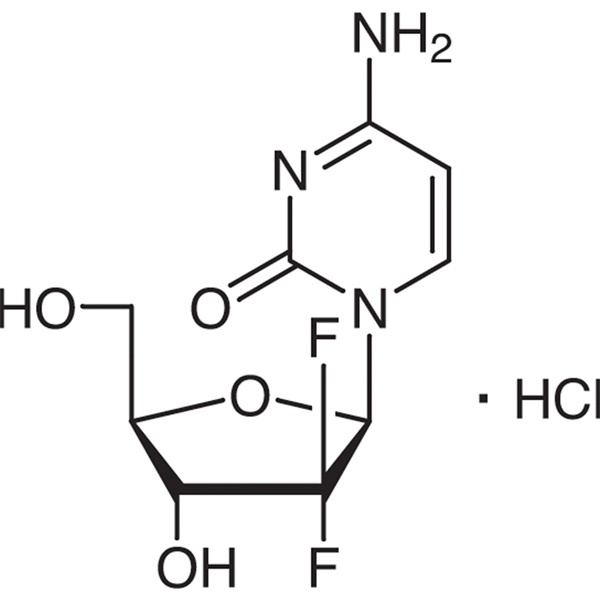
Gemsitabiinihydrokloridi (CAS: 122111-03-9) on synteettinen uusi difluorinukleosidilääke, joka on aineenvaihduntaa ja kasvaimia estävä.Eli Lilly and Company on tutkinut ja kehittänyt sen, ja se on hyväksytty listattavaksi Etelä-Afrikassa, Ruotsissa, Alankomaissa, Australiassa ja muissa maissa vuonna 1995. Yhdysvaltain elintarvike- ja lääkevirasto (FDA) hyväksyi sen ensilinjan terapiaksi. ei-pienisoluisen keuhkosyövän ja haimasyövän kliiniseen hoitoon.
Viime vuosina uudet lääkkeet, kuten Gemcitabine, Paclitaxel, Docetaxel, Vinorebine, ovat tehokkaita lääkkeitä ei-pienisoluisen keuhkosyövän (lyhennettynä NSCLC) hoitoon.Perinteisiin kemoterapialääkkeisiin verrattuna näiden lääkkeiden etuna on korkea parantava vaikutus ja alhainen toksisuus.Gemcitabine Hydrochloride on uuden sukupolven aineenvaihduntalääkkeitä ja eräänlainen erityinen solusyklin lääke, jolla on tärkeä rooli DNA-synteesivaiheessa, nimittäin solujen S-vaiheessa.Tietyissä olosuhteissa tämä lääke voi estää solujen etenemisen G1-vaiheesta S-vaiheeseen, ja sillä on voimakas syövän vastainen vaikutus ei-pienisoluiseen keuhkosyöpään (NSCLC).Ulkomaiset tutkimukset ovat osoittaneet, että yksittäisen gemsitabiinihydrokloridin hoidon tehokkuus on noin 18–35 %, kun taas sisplatiinihoidon tehokkuus on 41,7 %.Pitkälle edenneessä NSCLC:ssä karboplatiinin tehokas määrä on 16 %, mikä on samanlainen kuin sisplatiini, mutta sillä on alhainen toksisuus, erityisesti maha-suolikanavan reaktioiden, luuytimen suppression sekä munuaisten ja hermopäätteiden toksisten reaktioiden osalta.Yhdessä karboplatiinin kanssa niillä molemmilla on keskinäinen koordinaatio ja additiivinen vaikutus, ja ne voivat tuottaa korkeampia parantavia vaikutuksia.
Gemsitabiinihydrokloridi
C9H11F2N3O4·HCl 299,66
Sytidiini, 2'-deoksi-2',2'-difluori-, monohydrokloridi.
2'-deoksi-2',2'-difluorosytidiinimonohydrokloridi (β-isomeeri) [122111-03-9].
» Gemsitabiinihydrokloridi sisältää vähintään 97,5 prosenttia ja enintään 101,5 prosenttia C9H11F2N3O4·HCl:a sellaisenaan laskettuna.
[Varoitus - Gemsitabiinihydrokloridi on voimakas sytotoksinen aine.On oltava erittäin varovainen, jotta hiukkasten hengittäminen ja ihon altistuminen niille estetään.]
Pakkaus ja varastointi - Säilytä tiiviissä säiliössä.
Merkinnät - Kun se on tarkoitettu käytettäväksi ruiskeena käytettävien annosmuotojen valmistuksessa, etiketissä todetaan, että se on steriili tai sitä on käsiteltävä jatkokäsittelyn aikana injektoitavien annosmuotojen valmistuksen aikana.
USP-viitestandardit <11>-
USP Cytosine RS
USP Endotoxin RS
USP Gemcitabine Hydrochloride RS
Henkilöllisyystodistus-
V: Infrapuna-absorptio <197K>.
B: Se täyttää kloridi <191> -testien vaatimukset.
Ominaiskierto <781S>: +43 ja +50 välillä, 20 asteessa.
Testiliuos: 10 mg/ml.
pH <791>: välillä 2,0 - 3,0, liuoksessa, joka sisältää 10 mg/ml.
Sytytysjäännös <281>: enintään 0,1 %.
Raskasmetallit, menetelmä I <231>: 0,001 %.
Kromatografinen puhtaus-
Ratkaisu A - Jatka kuten Mobiilifaasille on annettu määrityksessä.
Liuos B – Valmista suodatettu ja kaasuttomaksi poistettu metanoli.
Liikkuva faasi - Käytä liuoksen A ja liuoksen B vaihtelevia seoksia kromatografisen järjestelmän ohjeiden mukaisesti.Tee säädöt tarvittaessa (katso Järjestelmän soveltuvuus kohdassa Kromatografia 621).
Järjestelmän soveltuvuusratkaisu - Jatka määrityksessä annettujen ohjeiden mukaisesti.
Vakioliuos – Liuota tarkasti punnittu määrä USP Gemcitabine Hydrochloride RS:ää ja USP Cytosine RS:ää veteen ja laimenna kvantitatiivisesti ja tarvittaessa vaiheittain, jotta saadaan liuos, jonka tunnettu konsentraatio on noin 2 µg/ml.
Testiliuos - Siirretään noin 50 mg tarkasti punnittua gemsitabiinihydrokloridia 25 ml:n mittapulloon, liuotetaan ja laimennetaan vedellä tilavuuteen ja sekoitetaan.
Kromatografiajärjestelmä (katso kromatografia 621) - Jatka kuten kohdassa Määritys on annettu.Kromatografi ohjelmoidaan seuraavasti.
Aika (minuutit) Liuos A (%) Liuos B (%) Eluointi
0–8 97 3 isokraattinen
8–13 97®50 3®50 lineaarinen gradientti
13–20 50 50 isokraattinen
20–25 50®97 50®3 uudelleentasapainotus
Kromatografoi järjestelmän soveltuvuusliuos ja tallenna huippuvasteet ohjeiden mukaisesti: suhteelliset retentioajat ovat noin 0,5 gemsitabiini-anomeerille ja 1,0 gemsitabiinille;erotuskyky R gemsitabiini-anomeerin ja gemsitabiinin välillä on vähintään 8,0;ja gemsitabiinin pyrstökerroin on enintään 1,5.Kromatografoi standardiliuos ja kirjaa huippuvasteet ohjeiden mukaisesti: suhteelliset retentioajat ovat noin 0,1 sytosiinille ja 1,0 gemsitabiinille;rinnakkaisinjektioiden suhteellinen standardipoikkeama on enintään 2,0 %.
Toimenpide – Injektoidaan erikseen tilavuus (noin 20 µl) standardiliuosta ja testiliuosta kromatografiin, kirjataan kromatogrammi ja mitataan kaikki huippuvasteet.Laske sytosiinin prosenttiosuus gemsitabiinin annoksesta kaavalla:
2,5 (Cc / W) (rt / rs)
jossa Cc on USP Cytosine RS:n pitoisuus standardiliuoksessa, ug/ml;W on käytetyn gemsitabiinin paino milligrammoina;rt on huippuvaste sytosiinille testiliuoksessa;ja rs on vaste sytosiinille standardiliuoksessa: sytosiinia ei löydy enempää kuin 0,1 %.Laske jokaisen muun epäpuhtauden kuin sytosiinin prosenttiosuus gemsitabiinin osassa, joka on otettu kaavalla:
2,5 (Cs / W) (ri / rs)
jossa Cs on USP Gemcitabine Hydrochloride RS:n pitoisuus standardiliuoksessa, ug/ml;W on käytetyn gemsitabiinin paino milligrammoina;ri on huippuvaste testiliuoksessa jokaiselle epäpuhtaudelle;ja rs on vaste, joka johtuu gemsitabiinista standardiliuoksessa: ei löydy enempää kuin 0,1 % gemsitabiini-anomeeriä tai muuta yksittäistä epäpuhtautta;ja kaikkien epäpuhtauksien summa on enintään 0,2 %.Jätä kaikkien epäpuhtauksien summasta pois kaikki piikit, jotka ovat kvantitatiivisen rajan (0,02 %) alapuolella.
Muut vaatimukset – Jos etiketissä todetaan, että gemsitabiinihydrokloridi on steriili, se täyttää bakteeriendotoksiineja ja steriiliyttä koskevat vaatimukset kohdassa Gemcitabine for Injection.Jos etiketissä sanotaan, että gemsitabiinihydrokloridia on jatkokäsiteltävä ruiskeena käytettävien annosmuotojen valmistuksen aikana, se täyttää gemsitabiinin injektioon tarkoitettuja bakteeriendotoksiineja koskevat vaatimukset.
Määritys-
Liikkuva faasi – Valmista suodatettu liuos, josta on poistettu kaasut ja joka sisältää 13,8 g yksiemäksistä natriumfosfaattia ja 2,5 ml fosforihappoa 1 000 ml:ssa vettä.[huomautus-Tämän liuoksen pH on välillä 2,4 - 2,6.]
Järjestelmän soveltuvuusliuos – Siirrä noin 10 mg gemsitabiinihydrokloridia pieneen injektiopulloon, lisää 4 ml liuosta, joka sisältää 168 mg kaliumhydroksidia/ml metanolia, sulje tiiviisti ja sonikoita.Kuumenna 55 °C:ssa 6-16 tuntia, anna jäähtyä ja siirrä sisältö 100 ml:n mittapulloon pesemällä peräkkäin 1-prosenttisella (v/v) fosforihapolla.Laimenna 1-prosenttisella fosforihapolla tilavuuteen ja sekoita.[huom. Tämä liuos sisältää noin 0,02 mg/ml gemsitabiinin a-anomeeriä.]
Vakiovalmiste - Liuota tarkasti punnittu määrä USP Gemcitabine Hydrochloride RS:ää veteen ja laimenna kvantitatiivisesti ja tarvittaessa vaiheittain vedellä, jotta saadaan liuos, jonka tunnettu konsentraatio on noin 0,1 mg/ml.
Määrityksen valmistelu - Siirrä noin 20 mg tarkasti punnittua gemsitabiinihydrokloridia 200 ml:n mittapulloon, liuotetaan ja laimennetaan vedellä tilavuuteen ja sekoitetaan.
Kromatografiajärjestelmä (katso Kromatografia <621>) - Nestekromatografi on varustettu 275 nm:n detektorilla ja 4,6 mm × 25 cm:n kolonnilla, joka sisältää 5 µm:n täytteen L7.Virtausnopeus on noin 1,2 ml minuutissa.Kromatografoi järjestelmän soveltuvuusliuos ja tallenna huippuvasteet ohjeiden mukaisesti: erotuskyky R gemsitabiini-anomeerin ja gemsitabiinin välillä on vähintään 8,0;ja gemsitabiinista määritetty pyrstökerroin on enintään 1,5.Kromatografoi standardivalmiste ja tallenna huippuvasteet menettelyn ohjeiden mukaisesti: suhteellinen standardipoikkeama toistetuissa injektioissa on enintään 1,0 %.
Toimenpide - Injektoi kromatografiin erikseen yhtä suuret tilavuudet (noin 20 µl) standardivalmistetta ja määritysvalmistetta, kirjaa kromatogrammit ja mittaa vasteet päähuippuille.Laske C9H11F2N3O4·HCl:n määrä milligrammoina gemsitabiinihydrokloridin osassa, joka on otettu kaavasta:
200 C (rU / rS)
jossa C on USP Gemcitabine Hydrochloride RS:n pitoisuus, mg/ml, standardivalmisteessa;ja rU ja rS ovat huippuvasteita, jotka on saatu määritysvalmisteesta ja standardivalmisteesta, vastaavasti.
-

Gemcitabine Hydrochloride CAS 122111-03-9 API U...
-

Gemsitabiini CAS 95058-81-4 -määritys 98,0-102,0 %
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Doxorubicin Hydrochloride CAS 25316-40-9 API US...
-

Enalapriilimaleaatti CAS 76095-16-4 -määritys 98,0-102...
-

Guanfacine Hydrochloride Guanfacine HCl CAS 291...
-

Irinotekaanihydrokloridi CAS 100286-90-6 Puhtaus...
-

Levetirasetaami LEV CAS 102767-28-2 API Factory U...
-

Naltreksonihydrokloridi CAS 16676-29-2 API USP...
-

Noskapiinihydrokloridihydraatti CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0–100,5 % USP B...
-

Darunavir CAS 206361-99-1 Anti-HIV Purity ≥99,0...
-

Etsetimibe CAS 163222-33-1 Puhtaus 98,5 % ~ 102,0 % (...
-

Lasofoksifeenitartraatti CAS 190791-29-8 Kiraalinen Pu...
-

Bortezomib CAS 179324-69-7 Puhtaus ≥99,0 % (HPLC)...
-

CAS 274901-16-5 Puhtaus ≥99,0 % (HPLC) API