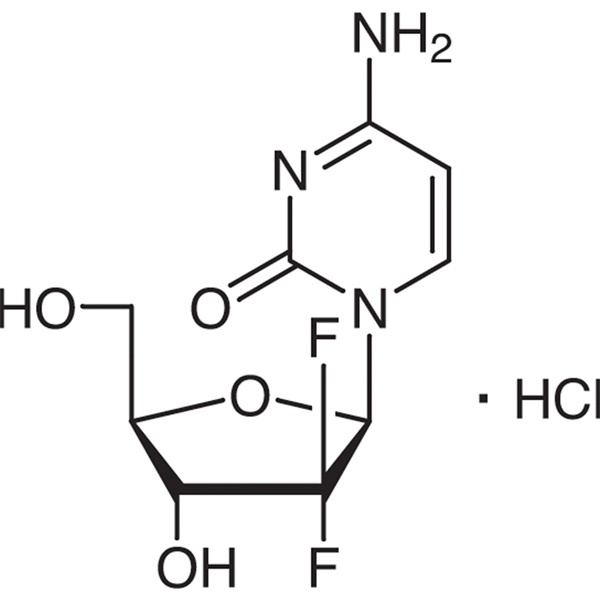
Chlorhydrate de gemcitabine CAS 122111-03-9 Norme API USP35
Ruifu Chemical est le principal fabricant de chlorhydrate de gemcitabine (CAS : 122111-03-9) avec une production commerciale de haute qualité.Ruifu Chemical peut fournir une livraison dans le monde entier, un prix compétitif, un excellent service, de petites et grandes quantités disponibles.Acheter du chlorhydrate de gemcitabine,Please contact: alvin@ruifuchem.com
| Nom chimique | Chlorhydrate de gemcitabine |
| Synonymes | Gemcitabine HCl;Chlorhydrate de 2'-désoxy-2',2'-difluorocytidine;dFdC ;dFdCyd ;Gemzar ;Chlorhydrate de LY188011 ;Gemcitera ;Gemsar |
| Numero CAS | 122111-03-9 |
| CAS associés | 95058-81-4 - Base libre |
| État des stocks | En stock, capacité de production 5 tonnes |
| Formule moléculaire | C9H12ClF2N3O4 |
| Masse moléculaire | 299,66 |
| Point de fusion | >250℃ |
| État d'expédition | Sous température ambiante |
| COA et MSDS | Disponible |
| Origine | Shangai, Chine |
| Marque | Chimique Ruifu |
| Article | Caractéristiques | Résultats |
| Apparence | Poudre cristalline blanche, inodore | Conforme |
| Solubilité | Soluble dans l'eau, légèrement soluble dans le méthanol, pratiquement insoluble dans l'acétone | Conforme |
| IR d'identification | Le spectre IR doit être concordant avec celle de l'étalon de référence | Conforme |
| Chlorure d'identification | Positif.Il répond aux exigences des tests pour le chlorure | Conforme |
| Apparence de la solution | Solution S en clair et pas plus intensément coloré que la solution de référence BY7 | Conforme |
| pH | 2.0~3.0 | 2.6 |
| Rotation spécifique [α]20/D | +43,0° à +50,0° | +47,5° |
| Métaux lourds (Pb) | ≤10ppm | <10 ppm |
| Perte au séchage | ≤1.00% | 0,3 % |
| Résidu à l'allumage | ≤0.10% | 0,03 % |
| Substances apparentées | ||
| Cytosine | ≤0.10% | 0,01 % |
| isomère α | ≤0.10% | 0,01 % |
| Toute autre impureté | ≤0.10% | 0,04 % |
| Impuretés totales | ≤0.20% | 0,1 % |
| Solvants résiduels | ||
| Méthanol | ≤0.30% | Non-détecté |
| Toluène | ≤0.01% | Non-détecté |
| Dichlorométhane | ≤0.01% | Non-détecté |
| Acétone | ≤0.50% | 0,1 % |
| Essai | 97,5 % ~ 101,5 % (calculé sur base séchée) | 99,9 % |
| Conclusion | Conforme à la norme USP35 | |
Emballer:Bouteille, sac en aluminium, tambour de 25 kg/carton, ou selon les exigences du client.
Condition de stockage:Gardez le récipient bien fermé et entreposez-le dans un entrepôt frais, sec et bien ventilé, à l'écart des substances incompatibles.Évitez l'exposition à la lumière directe du soleil, à l'humidité et à la chaleur excessive.
Expédition:Livrer dans le monde entier par avion, par FedEx / DHL Express.Fournir une livraison rapide et fiable.


Codes de risque R21 - Nocif par contact avec la peau
R36/38 - Irritant pour les yeux et la peau.
R46 - Peut causer des dommages génétiques héréditaires
R62 - Risque possible d'altération de la fertilité
R63 - Risque possible d'atteinte à l'enfant à naître
Description de sécurité S25 - Éviter le contact avec les yeux.
S26 - En cas de contact avec les yeux, laver immédiatement et abondamment avec de l'eau et consulter un spécialiste.
S36/37 - Porter un vêtement de protection et des gants appropriés.
S53 - Éviter l'exposition - se procurer des instructions spéciales avant utilisation.
WGK Allemagne 3
RTECS HA3840000
Code SH 2942000000
Le chlorhydrate de gemcitabine (CAS : 122111-03-9) est un nouveau médicament synthétique difluoronucléoside anti-métabolique et antinéoplasique.Il est recherché et développé par Eli Lilly and Company et approuvé pour être répertorié en Afrique du Sud, en Suède, aux Pays-Bas, en Australie et dans d'autres pays en 1995. La Food and Drug Administration (FDA) des États-Unis l'a approuvé comme traitement de première intention. pour le traitement clinique du cancer du poumon non à petites cellules et du cancer du pancréas.
Depuis quelques années, de nouveaux médicaments tels que la Gemcitabine, le Paclitaxel, le Docétaxel, la Vinorebine sont des médicaments efficaces pour le traitement du cancer du poumon non à petites cellules (en abrégé NSCLC).Par rapport aux médicaments de chimiothérapie traditionnels, ces médicaments présentent les avantages d'un effet curatif élevé et d'une faible toxicité.Le chlorhydrate de gemcitabine est une nouvelle génération de médicaments anti-métabolites et un type de médicament spécial pour le cycle cellulaire, jouant un rôle majeur dans la phase de synthèse de l'ADN, à savoir la phase S des cellules.Sous certaines conditions, ce médicament peut empêcher la progression des cellules de la phase G1 à la phase S, et avoir une forte activité anticancéreuse du cancer du poumon non à petites cellules (NSCLC).Des études étrangères ont montré que l'efficacité du traitement unique pour le NSCLC avec le chlorhydrate de gemcitabine uniquement est d'environ 18 % ~ 35 %, tandis que le traitement combiné avec le cisplatine l'efficacité pour le NSCLC est de 41,7 %.Dans le NSCLC avancé, le taux effectif de carboplatine est de 16 %, ce qui est similaire au cisplatine, mais a une faible toxicité, en particulier pour les réactions gastro-intestinales, la suppression de la moelle osseuse et la réaction toxique des terminaisons rénales et nerveuses.En combinaison avec le carboplatine, les deux ont une coordination mutuelle et un effet additif, et peuvent produire des effets curatifs plus élevés.
Chlorhydrate de gemcitabine
C9H11F2N3O4·HCl 299,66
Cytidine, 2′-désoxy-2′,2′-difluro-, monochlorhydrate.
Monochlorhydrate de 2′-désoxy-2′,2′-difluorocytidine (isomère β) [122111-03-9].
» Le chlorhydrate de gemcitabine contient pas moins de 97,5 % et pas plus de 101,5 % de C9H11F2N3O4·HCl, calculé tel quel.
[Attention - Le chlorhydrate de gemcitabine est un puissant agent cytotoxique.Il faut faire très attention pour éviter d'inhaler des particules et d'y exposer la peau.]
Emballage et stockage-Conserver dans des contenants étanches.
Étiquetage - Lorsqu'il est destiné à être utilisé dans la préparation de formes posologiques injectables, l'étiquette indique qu'il est stérile ou doit être soumis à un traitement ultérieur lors de la préparation de formes posologiques injectables.
Normes de référence USP <11>-
USP Cytosine RS
USP Endotoxine RS
USP Gemcitabine Hydrochloride RS
Identification-
A : Absorption infrarouge <197K>.
B : Il répond aux exigences des tests pour Chlorure <191>.
Rotation spécifique <781S> : entre +43 et +50, à 20.
Solution d'essai : 10 mg par mL.
pH <791> : entre 2,0 et 3,0, dans une solution contenant 10 mg par mL.
Résidu d'allumage <281> : pas plus de 0,1 %.
Métaux lourds, Méthode I <231> : 0,001 %.
Pureté chromatographique-
Solution A- Procédez comme indiqué pour la phase mobile dans le test.
Solution B-Préparer du méthanol filtré et dégazé.
Phase mobile - Utilisez des mélanges variables de solution A et de solution B comme indiqué sous Système chromatographique.Faire des ajustements, si nécessaire (voir Adéquation du système sous Chromatographie 621).
Solution d'adéquation du système - Procédez comme indiqué dans le test.
Solution standard - Dissoudre une quantité pesée avec précision de USP Gemcitabine Hydrochloride RS et USP Cytosine RS dans de l'eau, et diluer quantitativement, et par étapes si nécessaire, pour obtenir une solution ayant une concentration connue d'environ 2 µg par mL de chacun.
Solution d'essai - Transférer environ 50 mg de chlorhydrate de gemcitabine, pesés avec précision, dans une fiole jaugée de 25 ml, dissoudre et diluer avec de l'eau jusqu'au volume, et mélanger.
Système chromatographique (voir Chromatographie 621) - Procéder comme indiqué sous Dosage.Le chromatographe est programmé comme suit.
Temps (minutes) Solution A (%) Solution B (%) Élution
0–8 97 3 isocratique
8–13 97®50 3®50 dégradé linéaire
13–20 50 50 isocratique
20–25 50®97 50®3 rééquilibrage
Chromatographiez la solution d'adéquation du système et enregistrez les réponses maximales comme indiqué pour la procédure : les temps de rétention relatifs sont d'environ 0,5 pour la gemcitabine-anomère et de 1,0 pour la gemcitabine ;la résolution, R, entre la gemcitabine -anomère et la gemcitabine n'est pas inférieure à 8,0 ;et le facteur de traînée pour la gemcitabine n'est pas supérieur à 1,5.Chromatographiez la solution standard et enregistrez les réponses maximales comme indiqué pour la procédure : les temps de rétention relatifs sont d'environ 0,1 pour la cytosine et de 1,0 pour la gemcitabine ;l'écart type relatif pour les injections répétées n'est pas supérieur à 2,0 %.
Procédure-Injectez séparément un volume (environ 20 µL) de la solution standard et de la solution à tester dans le chromatographe, enregistrez le chromatogramme et mesurez toutes les réponses de pic.Calculer le pourcentage de cytosine dans la portion de Gemcitabine prise par la formule :
2.5(CC/W)(rt/rs)
dans laquelle Cc est la concentration de USP Cytosine RS dans la solution standard, en µg par mL ;W est le poids, en mg, de Gemcitabine prise ;rt est la réponse maximale pour la cytosine dans la solution test ;et rs est la réponse pour la cytosine dans la solution étalon : on ne trouve pas plus de 0,1 % de cytosine.Calculez le pourcentage de chaque impureté autre que la cytosine dans la portion de Gemcitabine prise par la formule :
2.5(Cs / W)(ri / rs)
dans laquelle Cs est la concentration de chlorhydrate de gemcitabine USP RS dans la solution étalon, en µg par mL ;W est le poids, en mg, de Gemcitabine prise ;ri est la réponse maximale pour chaque impureté dans la solution d'essai ;et rs est la réponse due à la gemcitabine dans la solution étalon : on ne trouve pas plus de 0,1 % de gemcitabine -anomère ou de toute autre impureté individuelle ;et la somme de toutes les impuretés n'est pas supérieure à 0,2 %.Exclure de la somme de toutes les impuretés tous les pics inférieurs à la limite de quantification (0,02 %).
Autres exigences - Lorsque l'étiquette indique que le chlorhydrate de gemcitabine est stérile, il répond aux exigences relatives aux endotoxines bactériennes et à la stérilité sous Gemcitabine pour injection.Lorsque l'étiquette indique que le chlorhydrate de gemcitabine doit être soumis à un traitement supplémentaire lors de la préparation des formes posologiques injectables, il répond aux exigences relatives aux endotoxines bactériennes sous Gemcitabine pour injection.
Essai-
Phase mobile-Préparer une solution filtrée et dégazée contenant 13,8 g de phosphate de sodium monobasique et 2,5 ml d'acide phosphorique dans 1000 ml d'eau.[note-Le pH de cette solution est compris entre 2,4 et 2,6.]
Solution d'adéquation du système - Transférez environ 10 mg de chlorhydrate de gemcitabine dans un petit flacon, ajoutez 4 ml d'une solution contenant 168 mg d'hydroxyde de potassium par ml de méthanol, fermez le bouchon et passez aux ultrasons.Chauffer à 55 °C pendant 6 à 16 heures, laisser refroidir et transférer le contenu dans une fiole jaugée de 100 mL avec des lavages successifs à l'acide phosphorique à 1 % (v/v).Diluer avec 1 % d'acide phosphorique jusqu'au volume et mélanger.[note-Cette solution contient environ 0,02 mg par mL de gemcitabine α-anomère.]
Préparation standard - Dissoudre une quantité pesée avec précision de chlorhydrate de gemcitabine RS USP dans de l'eau et diluer quantitativement, et par étapes si nécessaire, avec de l'eau pour obtenir une solution ayant une concentration connue d'environ 0,1 mg par ml.
Préparation du dosage - Transférer environ 20 mg de chlorhydrate de gemcitabine, pesés avec précision, dans une fiole jaugée de 200 ml, dissoudre et diluer avec de l'eau jusqu'au volume, et mélanger.
Système chromatographique (voir Chromatographie <621>) - Le chromatographe en phase liquide est équipé d'un détecteur de 275 nm et d'une colonne de 4,6 mm × 25 cm contenant un garnissage L7 de 5 µm.Le débit est d'environ 1,2 ml par minute.Chromatographiez la solution d'adéquation du système et enregistrez les réponses maximales comme indiqué pour la procédure : la résolution, R, entre la gemcitabine -anomère et la gemcitabine n'est pas inférieure à 8,0 ;et le facteur de traînée déterminé à partir de la gemcitabine n'est pas supérieur à 1,5.Chromatographiez la préparation standard et enregistrez les réponses maximales comme indiqué pour la procédure : l'écart-type relatif pour les injections répétées n'est pas supérieur à 1,0 %.
Procédure-Injecter séparément des volumes égaux (environ 20 µL) de la préparation standard et de la préparation du test dans le chromatographe, enregistrer les chromatogrammes et mesurer les réponses pour les pics principaux.Calculez la quantité, en mg, de C9H11F2N3O4·HCl dans la portion de chlorhydrate de gemcitabine prise par la formule :
200C(rU / rS)
dans laquelle C est la concentration, en mg par ml, de chlorhydrate de gemcitabine USP RS dans la préparation standard ;et rU et rS sont les réponses maximales obtenues à partir de la préparation du test et de la préparation standard, respectivement.
-

Chlorhydrate de gemcitabine CAS 122111-03-9 API U...
-

Gemcitabine CAS 95058-81-4 Dosage 98,0 ~ 102,0 %
-

Chlorhydrate de céfotiam CAS 66309-69-1 API USP S...
-

Chlorhydrate de doxorubicine CAS 25316-40-9 API US...
-

Maléate d'énalapril CAS 76095-16-4 Dosage 98,0 ~ 102...
-

Guanfacine Hydrochloride Guanfacine HCl CAS 291...
-

Chlorhydrate d'irinotécan CAS 100286-90-6 Pureté...
-

Lévétiracétam LEV CAS 102767-28-2 API Usine U...
-

Chlorhydrate de naltrexone CAS 16676-29-2 API USP...
-

Noscapine Hydrochloride Hydrate CAS 912-60-7 AP...
-

Lévodopa (L-DOPA) CAS 59-92-7 99.0 ~ 100.5% USP B...
-

Darunavir CAS 206361-99-1 Pureté anti-VIH ≥99.0...
-

Ézétimibe CAS 163222-33-1 Pureté 98,5 % ~ 102,0 % (...
-

Tartrate de lasofoxifène CAS 190791-29-8 Pu...
-

Bortezomib CAS 179324-69-7 Pureté ≥99.0% (HPLC)...
-

CAS 274901-16-5 Pureté ≥99.0% (HPLC) API