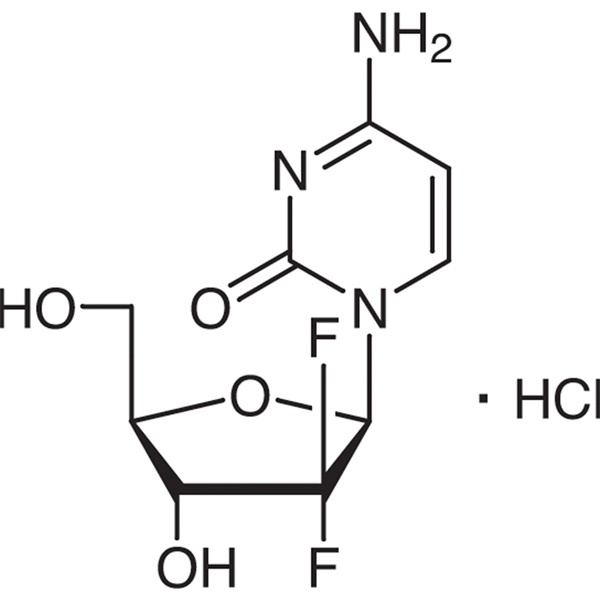
Gemcitabine-hidroklorid CAS 122111-03-9 API USP35 szabvány
A Ruifu Chemical a Gemcitabine Hydrochloride (CAS: 122111-03-9) vezető gyártója, kiváló minőségű, kereskedelmi gyártású.A Ruifu Chemical világméretű szállítást, versenyképes árat, kiváló szolgáltatást, kis és ömlesztett mennyiséget tud biztosítani.Gemcitabine-hidroklorid vásárlása,Please contact: alvin@ruifuchem.com
| Kémiai név | Gemcitabin-hidroklorid |
| Szinonimák | Gemcitabine HCl;2'-dezoxi-2',2'-difluor-citidin-hidroklorid;dFdC;dFdCyd;Gemzar;LY188011 hidroklorid;Gemcitera;Gemsar |
| CAS szám | 122111-03-9 |
| Kapcsolódó CAS | 95058-81-4 - Szabad bázis |
| Készlet állapota | Raktáron, termelési kapacitás 5 tonna |
| Molekuláris képlet | C9H12ClF2N3O4 |
| Molekuláris tömeg | 299,66 |
| Olvadáspont | >250 ℃ |
| Szállítási állapot | Környezeti hőmérséklet alatt |
| COA és MSDS | Elérhető |
| Eredet | Shanghai, Kína |
| Márka | Ruifu vegyszer |
| Tétel | Műszaki adatok | Eredmények |
| Kinézet | Fehér kristályos por, szagtalan | Megfelel |
| Oldhatóság | Vízben oldódik, metanolban kevéssé oldódik, acetonban gyakorlatilag nem oldódik | Megfelel |
| Azonosító IR | Az IR spektrumnak meg kell egyeznie hogy a referencia szabvány | Megfelel |
| Azonosítás Klorid | Pozitív.Megfelel a klorid vizsgálatok követelményeinek | Megfelel |
| A megoldás megjelenése | Az S oldat tiszta és nem intenzívebb színezett, mint a BY7 referenciaoldat | Megfelel |
| pH | 2,0-3,0 | 2.6 |
| Fajlagos forgás [α]20/D | +43,0° és +50,0° között | +47,5° |
| Nehézfémek (Pb) | ≤10 ppm | <10 ppm |
| Szárítási veszteség | ≤1,00% | 0,3% |
| Maradék gyújtáson | ≤0,10% | 0,03% |
| Kapcsolódó anyagok | ||
| Citozin | ≤0,10% | 0,01% |
| α-izomer | ≤0,10% | 0,01% |
| Bármilyen egyéb szennyeződés | ≤0,10% | 0,04% |
| Összes szennyeződés | ≤0,20% | 0,1% |
| Maradék oldószerek | ||
| Metanol | ≤0,30% | Nem található |
| Toluol | ≤0,01% | Nem található |
| diklór-metán | ≤0,01% | Nem található |
| Aceton | ≤0,50% | 0,1% |
| Próba | 97,5% ~ 101,5% (szárított alapra számítva) | 99,9% |
| Következtetés | Megfelel az USP35 szabványnak | |
Csomag:Palack, alumínium fóliazsák, 25 kg / kartondob, vagy az ügyfél igényei szerint.
Raktározási feltételek:A tartályt tartsa szorosan lezárva, és tárolja hűvös, száraz és jól szellőző raktárban, távol az összeférhetetlen anyagoktól.Kerülje a közvetlen napfénynek, nedvességnek és túlzott hőhatásnak való kitettséget.
Szállítás:Szállítás világszerte légi úton a FedEx / DHL Express segítségével.Gyors és megbízható szállítás biztosítása.


Kockázati kódok R21 - Bőrrel érintkezve ártalmas
R36/38 - Szem- és bőrizgató hatású.
R46 - Öröklődő genetikai károsodást okozhat
R62 - A termékenység károsodásának veszélye lehet
R63 - A születendő gyermeket károsíthatja
Biztonsági leírás S25 - Kerülni kell a szembe jutást.
S26 - Ha szembe jut, bő vízzel azonnal ki kell mosni és orvoshoz kell fordulni.
S36/37 - Megfelelő védőruházatot és védőkesztyűt kell viselni.
S53 - Kerülni kell az expozíciót - használat előtt szerezze be a különleges használati utasítást.
WGK Németország 3
RTECS HA3840000
HR-kód 2942000000
A gemcitabine-hidroklorid (CAS: 122111-03-9) egy szintetikus új difluor-nukleozid gyógyszer, amely anyagcsere- és daganatellenes hatású.Az Eli Lilly and Company kutatja és fejleszti, és 1995-ben engedélyezték a jegyzékbe vételt Dél-Afrikában, Svédországban, Hollandiában, Ausztráliában és más országokban. Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) első vonalbeli terápiaként engedélyezte. nem kissejtes tüdőrák és hasnyálmirigyrák klinikai kezelésére.
Az elmúlt években az olyan új gyógyszerek, mint a Gemcitabine, Paclitaxel, Docetaxel, Vinorebin hatékony gyógyszerek a nem-kissejtes tüdőrák (rövidítve NSCLC) kezelésére.A hagyományos kemoterápiás gyógyszerekkel összehasonlítva ezeknek a gyógyszereknek az előnyei a magas gyógyító hatás és az alacsony toxicitás.A Gemcitabine Hydrochloride egy új generációs anti-metabolit gyógyszer, és egyfajta speciális gyógyszer a sejtciklushoz, amely fontos szerepet játszik a DNS szintézis fázisában, nevezetesen a sejtek S fázisában.Bizonyos körülmények között ez a gyógyszer megakadályozhatja a sejtek progresszióját a G1-fázisból az S-fázisba, és erős rákellenes hatással bír a nem-kissejtes tüdőrák (NSCLC) esetében.Külföldi tanulmányok kimutatták, hogy a csak gemcitabin-hidrokloriddal végzett egyszeri kezelés hatékonysága NSCLC esetén körülbelül 18-35%, míg a ciszplatinnal kombinált kezelés hatékonysága NSCLC esetén 41,7%.Előrehaladott NSCLC-ben a karboplatin hatásos aránya 16%, ami hasonló a ciszplatinhoz, de alacsony toxicitású, különösen a gyomor-bélrendszeri reakciók, a csontvelő-szuppresszió és a vese- és idegvégződések toxikus reakciói esetében.Karboplatinnal kombinálva mindkettő kölcsönösen koordináló és additív hatású, és magasabb gyógyító hatást fejt ki.
Gemcitabin-hidroklorid
C9H11F2N3O4·HCl 299,66
Citidin, 2'-dezoxi-2',2'-difluor-, monohidroklorid.
2'-dezoxi-2',2'-difluor-citidin-monohidroklorid (β-izomer) [122111-03-9].
» A Gemcitabine-hidroklorid legalább 97,5 százalék és legfeljebb 101,5 százalék C9H11F2N3O4·HCl-t tartalmaz, a jelenlegi alapon számítva.
[Vigyázat - A gemcitabin-hidroklorid erős citotoxikus szer.Nagy gondot kell fordítani a részecskék belélegzésének és a bőr kitételének megakadályozására.]
Csomagolás és tárolás – szorosan lezárt tartályokban kell tárolni.
Címkézés – Ha injekciós adagolási formák készítésére szánják, a címkén az szerepel, hogy steril, vagy további feldolgozásnak kell alávetni az injekciós adagolási formák elkészítése során.
USP referencia szabványok <11>-
USP Cytosine RS
USP Endotoxin RS
USP Gemcitabine Hydrochloride RS
Azonosítás-
V: Infravörös elnyelés <197K>.
B: Megfelel a klorid <191> teszt követelményeinek.
Fajlagos forgás <781S>: +43 és +50 között, 20-nál.
Vizsgálati oldat: 10 mg/ml.
pH <791>: 2,0 és 3,0 között, 10 mg/ml oldatban.
Izzítási maradék <281>: legfeljebb 0,1%.
Nehézfémek, I. módszer <231>: 0,001%.
Kromatográfiai tisztaság -
A megoldás – Folytassa az Assay-ben a mobilfázisnál leírtak szerint.
B oldat – Készítsünk szűrt és gáztalanított metanolt.
Mozgófázis: Az A és B oldat változó keverékét használja a kromatográfiás rendszerben leírtak szerint.Szükség esetén végezze el a beállításokat (lásd: Rendszeralkalmasság a Chromatography 621 alatt).
Rendszeralkalmassági megoldás – Folytassa az Assay-ben leírtak szerint.
Standard oldat – Oldjon fel egy pontosan kimért mennyiségű USP Gemcitabine Hydrochloride RS-t és USP Cytosine RS-t vízben, és hígítsa fel mennyiségileg, és szükség esetén fokozatosan, hogy olyan oldatot kapjon, amelynek ismert koncentrációja mindegyikből körülbelül 2 µg/ml.
Vizsgálati oldat – Vigyen át körülbelül 50 mg gemcitabin-hidrokloridot pontosan lemérve egy 25 ml-es mérőlombikba, oldja fel és hígítsa fel vízzel, majd keverje össze.
Kromatográfiás rendszer (lásd: Chromatography 621) - Folytassa a Vizsgálat részben leírtak szerint.A kromatográf a következőképpen van programozva.
Idő (perc) A oldat (%) B oldat (%) Elúció
0–8 97 3 izokratikus
8–13 97®50 3®50 lineáris gradiens
13–20 50 50 izokratikus
20–25 50®97 50®3 újraegyensúlyozás
Kromatografálja a rendszeralkalmassági oldatot, és rögzítse a csúcsválaszokat az eljárásnál leírtak szerint: a relatív retenciós idő körülbelül 0,5 a gemcitabin-anomer esetében és 1,0 a gemcitabin esetében;a gemcitabin-anomer és a gemcitabin közötti R felbontás nem kisebb, mint 8,0;és a gemcitabin faroktényezője nem több, mint 1,5.Kromatografálja a standard oldatot, és rögzítse a csúcsválaszokat az eljárásnál leírtak szerint: a relatív retenciós idő körülbelül 0,1 a citozin és 1,0 a gemcitabin esetében;az ismételt injekciók relatív szórása nem több, mint 2,0%.
Eljárás – Fecskendezzen be egy térfogatot (körülbelül 20 µL) a standard oldatból és a tesztoldatból a kromatográfba, rögzítse a kromatogramot, és mérje meg az összes csúcsválaszt.Számítsa ki a citozin százalékos arányát a gemcitabin részében a következő képlettel:
2,5 (Cc / W) (rt / rs)
amelyben Cc az USP Cytosine RS koncentrációja a standard oldatban, µg/ml-ben;W a bevitt gemcitabin tömege mg-ban;rt a citozinra adott válasz csúcsértéke a tesztoldatban;és rs a standard oldatban a citozinra adott válasz: a citozin legfeljebb 0,1%-a található.Számítsa ki a citozintól eltérő szennyeződések százalékos arányát a gemcitabin részében a következő képlettel:
2,5 (Cs / W) (ri / rs)
amelyben Cs az USP Gemcitabine Hydrochloride RS koncentrációja a standard oldatban, µg/ml-ben;W a bevitt gemcitabin tömege mg-ban;ri a tesztoldat minden szennyezőjének válaszcsúcsa;és rs a standard oldatban lévő gemcitabinnak köszönhető válasz: legfeljebb 0,1% gemcitabin-anomert vagy bármilyen más egyedi szennyeződést találunk;és az összes szennyeződés összege nem több, mint 0,2%.Az összes szennyeződés összegéből kizárjuk azokat a csúcsokat, amelyek a mennyiségi határ (0,02%) alatt vannak.
Egyéb követelmények – Ha a címkén az szerepel, hogy a gemcitabin-hidroklorid steril, az megfelel a bakteriális endotoxinokra és a sterilitásra vonatkozó követelményeknek a Gemcitabine for Injection alatt.Ahol a címke azt írja ki, hogy a gemcitabin-hidrokloridot további feldolgozásnak kell alávetni az injekciós adagolási formák elkészítése során, az megfelel a Gemcitabine for Injection alatti bakteriális endotoxinokra vonatkozó követelményeknek.
Próba-
Mozgófázis – Készítsünk szűrt és gáztalanított oldatot, amely 13,8 g egybázisú nátrium-foszfátot és 2,5 ml foszforsavat tartalmaz 1000 ml vízben.[Megjegyzés-Ennek az oldatnak a pH-ja 2,4 és 2,6 között van.]
Rendszeralkalmassági oldat – Töltsön át körülbelül 10 mg gemcitabin-hidrokloridot egy kis fiolába, adjon hozzá 4 ml olyan oldatot, amely 168 mg kálium-hidroxidot tartalmaz ml metanolban, zárja le szorosan, és ultrahanggal kezelje.Melegítsük 55 °C-on 6-16 órán át, hagyjuk lehűlni, és töltsük át a tartalmát egy 100 ml-es mérőlombikba, egymást követően 1%-os (v/v) foszforsavval.Hígítsuk térfogatra 1%-os foszforsavval, és keverjük össze.[Megjegyzés - Ez az oldat körülbelül 0,02 mg/ml gemcitabin α-anomert tartalmaz.]
Szabványos készítmény – Oldjon fel egy pontosan kimért mennyiségű USP Gemcitabine Hydrochloride RS-t vízben, és hígítsa fel mennyiségileg, és szükség esetén lépésenként vízzel, hogy olyan oldatot kapjon, amelynek ismert koncentrációja körülbelül 0,1 mg/ml.
Vizsgálat előkészítése – Vigyen át körülbelül 20 mg gemcitabin-hidrokloridot pontosan lemérve egy 200 ml-es mérőlombikba, oldja fel és hígítsa fel vízzel, majd keverje össze.
Kromatográfiás rendszer (lásd: Kromatográfia <621>) – A folyadékkromatográf 275 nm-es detektorral és 4,6 mm × 25 cm-es oszloppal van felszerelve, amely 5 µm L7 töltetet tartalmaz.Az áramlási sebesség körülbelül 1,2 ml/perc.Kromatografálja a rendszeralkalmassági oldatot, és rögzítse a csúcsválaszokat az eljárásnál leírtak szerint: a gemcitabin-anomer és a gemcitabin közötti R felbontás nem kisebb, mint 8,0;és a gemcitabinból meghatározott faroktényező legfeljebb 1,5.Kromatografálja a standard készítményt, és rögzítse a csúcsválaszokat az eljárásnál leírtak szerint: az ismételt injekciók relatív szórása nem több, mint 1,0%.
Eljárás – Fecskendezzen be külön-külön egyenlő térfogatú (körülbelül 20 µL) standard készítményt és vizsgálati készítményt a kromatográfba, rögzítse a kromatogramokat, és mérje meg a fő csúcsok válaszait.Számítsa ki a C9H11F2N3O4·HCl mennyiségét mg-ban a gemcitabin-hidroklorid részében a következő képlettel:
200 C (rU / rS)
amelyben C az USP Gemcitabine Hydrochloride RS koncentrációja mg/ml-ben a standard készítményben;és az rU és rS a vizsgálati készítményből és a standard készítményből kapott csúcsválaszok.
-

Gemcitabine Hydrochloride CAS 122111-03-9 API U...
-

Gemcitabine CAS 95058-81-4 Assay 98,0-102,0%
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Doxorubicin Hydrochloride CAS 25316-40-9 API US...
-

Enalapril Maleate CAS 76095-16-4 Assay 98,0-102...
-

Guanfacine-hidroklorid Guanfacin HCl CAS 291...
-

Irinotekán-hidroklorid CAS 100286-90-6 Tisztaság...
-

Levetiracetam LEV CAS 102767-28-2 API Factory U...
-

Naltrexone-hidroklorid CAS 16676-29-2 API USP...
-

Noszkapin-hidroklorid-hidrát CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0–100,5% USP B...
-

Darunavir CAS 206361-99-1 HIV-ellenes tisztaság ≥99,0...
-

Ezetimibe CAS 163222-33-1 Tisztaság 98,5% ~ 102,0% (...
-

Lazofoxifen-tartarát CAS 190791-29-8 Királis Pu...
-

Bortezomib CAS 179324-69-7 Tisztaság ≥99,0% (HPLC)...
-

CAS 274901-16-5 tisztaság ≥99,0% (HPLC) API