Gemcitabina cloridrato CAS 122111-03-9 API USP35 Standard
Ruifu Chemical è il principale produttore di gemcitabina cloridrato (CAS: 122111-03-9) con una produzione commerciale di alta qualità.Ruifu Chemical è in grado di fornire consegne in tutto il mondo, prezzi competitivi, un servizio eccellente, quantità piccole e all'ingrosso disponibili.Acquista gemcitabina cloridrato,Please contact: alvin@ruifuchem.com
| Nome chimico | Gemcitabina cloridrato |
| Sinonimi | Gemcitabina cloridrato;cloridrato di 2'-deossi-2',2'-difluorocitidina;dFdC;dFdCid;Gemzar;LY188011 Cloridrato;Gemcitera;Gemsar |
| Numero CAS | 122111-03-9 |
| CAS correlati | 95058-81-4 - Base libera |
| Stato delle scorte | In Magazzino, Capacità Produttiva 5 Ton |
| Formula molecolare | C9H12ClF2N3O4 |
| Peso molecolare | 299,66 |
| Punto di fusione | >250℃ |
| Condizioni di spedizione | A temperatura ambiente |
| Certificato di autenticità e scheda di sicurezza | Disponibile |
| Origine | Shanghai, Cina |
| Marca | Ruifu chimica |
| Articolo | Specifiche | Risultati |
| Aspetto | Polvere cristallina bianca, inodore | Conforme |
| Solubilità | Solubile in acqua, leggermente solubile in metanolo, praticamente insolubile in acetone | Conforme |
| Identificazione IR | Lo spettro IR dovrebbe essere concorde con quella della norma di riferimento | Conforme |
| Identificazione Cloruro | Positivo.Soddisfa i requisiti dei test per il cloruro | Conforme |
| Aspetto della soluzione | Soluzione S in chiaro e non più intensamente colorato rispetto alla soluzione di riferimento BY7 | Conforme |
| pH | 2.0~3.0 | 2.6 |
| Rotazione specifica [α]20/D | da +43,0° a +50,0° | +47,5° |
| Metalli pesanti (Pb) | ≤10 ppm | <10 ppm |
| Perdita all'essiccamento | ≤1,00% | 0,3% |
| Residuo all'accensione | ≤0,10% | 0,03% |
| Sostanze correlate | ||
| Citosina | ≤0,10% | 0,01% |
| α-isomero | ≤0,10% | 0,01% |
| Qualsiasi altra impurità | ≤0,10% | 0,04% |
| Impurità totali | ≤0,20% | 0,1% |
| Solventi residui | ||
| Metanolo | ≤0,30% | Non rilevata |
| Toluene | ≤0,01% | Non rilevata |
| Diclorometano | ≤0,01% | Non rilevata |
| Acetone | ≤0,50% | 0,1% |
| Saggio | 97,5%~101,5% (calcolato su base essiccata) | 99,9% |
| Conclusione | Conforme allo standard USP35 | |
Pacchetto:Bottiglia, sacchetto di alluminio, tamburo da 25 kg/cartone o in base alle esigenze del cliente.
Condizioni di conservazione:Tenere il contenitore ben chiuso e conservare in un magazzino fresco, asciutto e ben ventilato lontano da sostanze incompatibili.Evitare l'esposizione alla luce solare diretta, all'umidità e al calore eccessivo.
Spedizione:Consegna in tutto il mondo per via aerea, tramite FedEx / DHL Express.Fornire una consegna rapida e affidabile.


Codici di rischio R21 - Nocivo a contatto con la pelle
R36/38 - Irritante per gli occhi e la pelle.
R46 - Può provocare alterazioni genetiche ereditarie
R62 - Possibile rischio di ridotta fertilità
R63 - Possibile rischio di danni ai bambini non ancora nati
Sicurezza Descrizione S25 - Evitare il contatto con gli occhi.
S26 - In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico.
S36/37 - Usare indumenti protettivi e guanti adatti.
S53 - Evitare l'esposizione - procurarsi speciali istruzioni prima dell'uso.
WGK Germania 3
RTECS HA3840000
Codice SA 2942000000
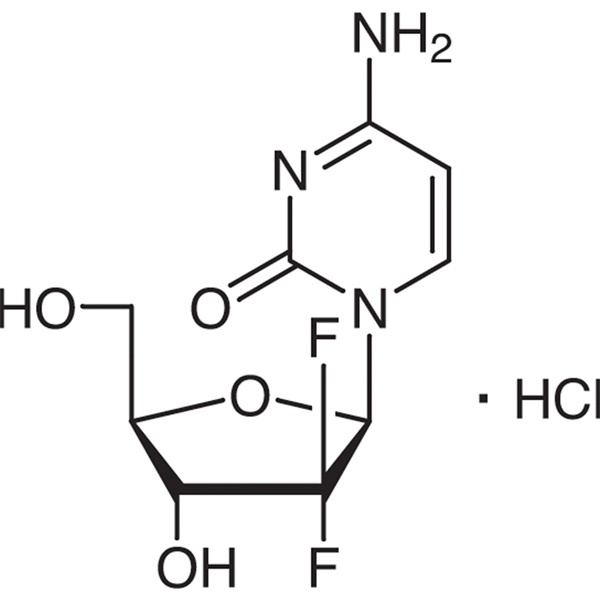
La gemcitabina cloridrato (CAS: 122111-03-9) è un nuovo farmaco nucleosidico difluoro sintetico che è antimetabolico e antineoplastico.È ricercato e sviluppato da Eli Lilly and Company e approvato per essere elencato in Sud Africa, Svezia, Paesi Bassi, Australia e altri paesi nel 1995. La Food and Drug Administration (FDA) degli Stati Uniti lo ha approvato come terapia di prima linea per il trattamento clinico del carcinoma polmonare non a piccole cellule e del carcinoma pancreatico.
Negli ultimi anni, nuovi farmaci come Gemcitabine, Paclitaxel, Docetaxel, Vinorebine sono farmaci efficaci per il trattamento del carcinoma polmonare non a piccole cellule (NSCLC abbreviato).Rispetto ai tradizionali farmaci chemioterapici, questi farmaci presentano i vantaggi di un elevato effetto curativo e di una bassa tossicità.La gemcitabina cloridrato è una nuova generazione di farmaci anti-metaboliti e un tipo di medicinale speciale per il ciclo cellulare, che svolge un ruolo importante nella fase di sintesi del DNA, vale a dire la fase S delle cellule.In determinate condizioni, questo medicinale può impedire la progressione delle cellule dalla fase G1 alla fase S e avere una forte attività antitumorale carcinoma polmonare non a piccole cellule (NSCLC).Studi esteri hanno dimostrato che l'efficacia del trattamento singolo per il NSCLC con la sola gemcitabina cloridrato è di circa il 18%~35%, mentre la combinazione del trattamento con cisplatino l'efficienza per il NSCLC è del 41,7%.Nel NSCLC avanzato, il tasso effettivo di carboplatino è del 16%, che è simile al cisplatino, ma ha una bassa tossicità, specialmente per le reazioni gastrointestinali, la soppressione del midollo osseo e la reazione tossica del rene e delle terminazioni nervose.In combinazione con il carboplatino, entrambi hanno coordinazione reciproca ed effetto additivo e possono produrre effetti curativi più elevati.
Gemcitabina cloridrato
C9H11F2N3O4·HCl 299,66
Citidina, 2′-deossi-2′,2′-difluro-, monocloridrato.
Monocloridrato di 2′-deossi-2′,2′-difluorocitidina (β-isomero) [122111-03-9].
» La gemcitabina cloridrato contiene non meno del 97,5 percento e non più del 101,5 percento di C9H11F2N3O4·HCl, calcolato così com'è.
[Attenzione: la gemcitabina cloridrato è un potente agente citotossico.Bisogna fare molta attenzione per evitare di inalare particelle ed esporre la pelle ad esse.]
Confezionamento e stoccaggio-Conservare in contenitori stretti.
Etichettatura-Dove è destinato all'uso nella preparazione di forme di dosaggio iniettabili, l'etichetta indica che è sterile o deve essere sottoposto a ulteriore elaborazione durante la preparazione di forme di dosaggio iniettabili.
Standard di riferimento USP <11>-
USP Citosina RS
USP Endotossina RS
USP Gemcitabina cloridrato RS
Identificazione-
A: Assorbimento infrarosso <197K>.
B: Soddisfa i requisiti dei test per Cloruro <191>.
Rotazione specifica <781S>: tra +43 e +50, a 20.
Soluzione di prova: 10 mg per ml.
pH <791>: tra 2,0 e 3,0, in una soluzione contenente 10 mg per mL.
Residuo alla combustione <281>: non più dello 0,1%.
Metalli pesanti, metodo I <231>: 0,001%.
Purezza cromatografica-
Soluzione A- Procedere come indicato per la fase mobile del saggio.
Soluzione B-Preparare il metanolo filtrato e degassato.
Fase mobile: utilizzare miscele variabili di soluzione A e soluzione B come indicato nel sistema cromatografico.Effettuare le regolazioni, se necessario (vedere Idoneità del sistema in Cromatografia 621).
Soluzione di idoneità del sistema: procedere come indicato nel test.
Soluzione standard: sciogliere una quantità accuratamente pesata di USP Gemcitabine Hydrochloride RS e USP Cytosine RS in acqua e diluire quantitativamente e gradualmente se necessario, per ottenere una soluzione con una concentrazione nota di circa 2 µg per mL di ciascuna.
Soluzione test-Trasferire circa 50 mg di Gemcitabine Hydrochloride, accuratamente pesati, in un matraccio tarato da 25 mL, sciogliere e diluire con acqua fino a volume e miscelare.
Sistema cromatografico (vedere Cromatografia 621)-Procedere come indicato in Assay.Il cromatografo è programmato come segue.
Tempo (minuti) Soluzione A (%) Soluzione B (%) Eluizione
0–8 97 3 isocratico
8–13 97®50 3®50 gradiente lineare
13–20 50 50 isocratico
20–25 50®97 50®3 riequilibrio
Cromatografare la soluzione di idoneità del sistema e registrare le risposte di picco come indicato per la procedura: i tempi di ritenzione relativi sono circa 0,5 per gemcitabina -anomero e 1,0 per gemcitabina;la risoluzione, R, tra gemcitabina -anomero e gemcitabina non è inferiore a 8,0;e il fattore di scodamento per la gemcitabina non è superiore a 1,5.Cromatografare la soluzione standard e registrare le risposte di picco come indicato per la procedura: i tempi di ritenzione relativi sono circa 0,1 per la citosina e 1,0 per la gemcitabina;la deviazione standard relativa per le iniezioni ripetute non è superiore al 2,0%.
Procedura-Iniettare separatamente un volume (circa 20 µL) della soluzione standard e della soluzione test nel cromatografo, registrare il cromatogramma e misurare tutte le risposte di picco.Calcolare la percentuale di citosina nella porzione di Gemcitabina assunta dalla formula:
2.5(Cc/W)(rt/rs)
in cui Cc è la concentrazione di USP Cytosine RS nella soluzione Standard, in µg per mL;W è il peso, in mg, della gemcitabina assunta;rt è la risposta di picco per la citosina nella soluzione test;e rs è la risposta per la citosina nella soluzione standard: non si trova più dello 0,1% di citosina.Calcolare la percentuale di ciascuna impurità diversa dalla citosina nella porzione di Gemcitabina presa dalla formula:
2.5(Cs / W)(ri / rs)
in cui Cs è la concentrazione di USP Gemcitabine Hydrochloride RS nella soluzione standard, in µg per mL;W è il peso, in mg, della gemcitabina assunta;ri è la risposta di picco per ogni impurità nella soluzione Test;e rs è la risposta dovuta alla gemcitabina nella soluzione standard: non si trova più dello 0,1% di gemcitabina -anomero o di qualsiasi altra impurità individuale;e la somma di tutte le impurità non è superiore allo 0,2%.Escludere dalla somma di tutte le impurezze eventuali picchi inferiori al limite di quantificazione (0,02%).
Altri requisiti: laddove l'etichetta affermi che la gemcitabina cloridrato è sterile, soddisfa i requisiti per le endotossine batteriche e la sterilità ai sensi della gemcitabina per iniezione.Laddove l'etichetta affermi che la gemcitabina cloridrato deve essere sottoposta a un'ulteriore elaborazione durante la preparazione delle forme di dosaggio iniettabili, soddisfa i requisiti per le endotossine batteriche in gemcitabina per iniezione.
Saggio-
Fase mobile: preparare una soluzione filtrata e degasata contenente 13,8 g di fosfato di sodio monobasico e 2,5 mL di acido fosforico in 1000 mL di acqua.[nota: il pH di questa soluzione è compreso tra 2,4 e 2,6.]
Soluzione di idoneità del sistema: trasferire circa 10 mg di gemcitabina cloridrato in una piccola fiala, aggiungere 4 mL di una soluzione contenente 168 mg di idrossido di potassio per mL di metanolo, tappare bene e sonicare.Riscaldare a 55 per 6-16 ore, lasciare raffreddare e trasferire il contenuto in un matraccio tarato da 100 mL con successivi lavaggi di acido fosforico all'1% (v/v).Diluire con acido fosforico all'1% a volume e mescolare.[nota: questa soluzione contiene circa 0,02 mg per mL di gemcitabina α-anomero.]
Preparazione standard-Sciogliere una quantità accuratamente pesata di USP Gemcitabine Hydrochloride RS in acqua e diluire quantitativamente, e gradualmente se necessario, con acqua per ottenere una soluzione con una concentrazione nota di circa 0,1 mg per mL.
Preparazione del dosaggio: trasferire circa 20 mg di gemcitabina cloridrato, accuratamente pesati, in un matraccio tarato da 200 mL, sciogliere e diluire con acqua fino a volume e miscelare.
Sistema cromatografico (vedere Cromatografia <621>)-Il cromatografo liquido è dotato di un rivelatore da 275 nm e di una colonna da 4,6 mm × 25 cm che contiene un impaccamento L7 da 5 µm.La portata è di circa 1,2 ml al minuto.Cromatografare la soluzione di idoneità del sistema e registrare le risposte di picco come indicato per la procedura: la risoluzione, R, tra l'anomero gemcitabina e la gemcitabina non è inferiore a 8,0;e il fattore di scodamento determinato dalla gemcitabina non è superiore a 1,5.Cromatografare la preparazione dello standard e registrare le risposte di picco come indicato per la procedura: la deviazione standard relativa per le iniezioni replicate non è superiore all'1,0%.
Procedura-Iniettare separatamente volumi uguali (circa 20 µL) della preparazione dello standard e della preparazione del test nel cromatografo, registrare i cromatogrammi e misurare le risposte per i picchi principali.Calcolare la quantità, in mg, di C9H11F2N3O4·HCl nella porzione di Gemcitabina cloridrato presa dalla formula:
200C(rU/rS)
in cui C è la concentrazione, in mg per mL, di USP Gemcitabine Hydrochloride RS nella preparazione Standard;e rU e rS sono le risposte di picco ottenute rispettivamente dalla preparazione del saggio e dalla preparazione dello standard.
-

Gemcitabina cloridrato CAS 122111-03-9 API U...
-

Gemcitabina CAS 95058-81-4 Analisi 98,0~102,0%
-

Cefotiam cloridrato CAS 66309-69-1 API USP S...
-

Doxorubicina cloridrato CAS 25316-40-9 API US...
-

Enalapril maleato CAS 76095-16-4 Saggio 98,0 ~ 102 ...
-

Guanfacine cloridrato Guanfacine HCl CAS 291...
-

Irinotecan cloridrato CAS 100286-90-6 Purezza...
-

Levetiracetam LEV CAS 102767-28-2 API Factory U...
-

Naltrexone cloridrato CAS 16676-29-2 API USP...
-

Noscapina cloridrato idrato CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Darunavir CAS 206361-99-1 Purezza anti-HIV ≥99.0...
-

Ezetimibe CAS 163222-33-1 Purezza 98,5% ~ 102,0% (...
-

Lasofoxifene tartrato CAS 190791-29-8 Chiral Pu...
-

Bortezomib CAS 179324-69-7 Purezza ≥99,0% (HPLC)...
-

CAS 274901-16-5 Purezza ≥99,0% (HPLC) API