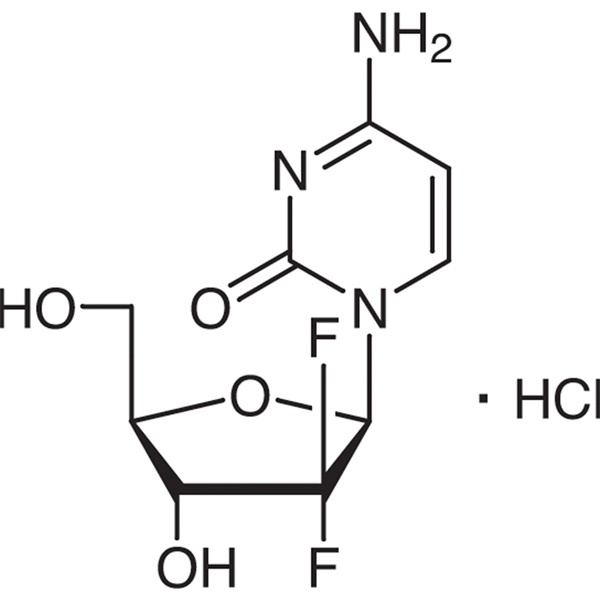
Гемцитабин гидрохлориді CAS 122111-03-9 API USP35 стандарты
Ruifu Chemical - жоғары сапалы, коммерциялық өндірісі бар Gemcitabine Hydrochloride (CAS: 122111-03-9) жетекші өндірушісі.Ruifu Chemical бүкіл әлем бойынша жеткізуді, бәсекеге қабілетті бағаны, тамаша қызмет көрсетуді, қол жетімді шағын және көлемді мөлшерлерді қамтамасыз ете алады.Гемцитабин гидрохлоридін сатып алыңыз,Please contact: alvin@ruifuchem.com
| Химиялық атауы | Гемцитабин гидрохлориді |
| Синонимдер | Гемцитабин HCl;2'-Деокси-2',2'-Дифтороцитидин гидрохлориді;dFdC;dFdCyd;Гемзар;LY188011 гидрохлориді;Gemcitera;Gemsar |
| CAS нөмірі | 122111-03-9 |
| Қатысты CAS | 95058-81-4 - Тегін база |
| Акция күйі | Қоймада, өндірістік қуаты 5 тонна |
| Молекулалық формула | C9H12ClF2N3O4 |
| Молекулалық салмақ | 299,66 |
| Еру нүктесі | >250℃ |
| Жеткізу жағдайы | Қоршаған орта температурасының астында |
| COA және MSDS | Қол жетімді |
| Шығу тегі | Шанхай, Қытай |
| Бренд | Ruifu химиялық |
| Элемент | Техникалық сипаттамалар | Нәтижелер |
| Сыртқы түрі | Ақ кристалды ұнтақ, иіссіз | Сәйкес келеді |
| Ерігіштік | Суда ериді, метанолда аз ериді, ацетонда іс жүзінде ерімейді | Сәйкес келеді |
| Сәйкестендіру IR | ИК спектрі сәйкес болуы керек эталондық стандартқа сәйкес | Сәйкес келеді |
| Анықтау хлориді | Оң.Ол хлоридке арналған сынақтардың талаптарына сәйкес келеді | Сәйкес келеді |
| Ерітіндінің сыртқы түрі | S ерітіндісі мөлдір және қарқынды емес BY7 эталондық ерітіндіге қарағанда түсті | Сәйкес келеді |
| pH | 2,0~3,0 | 2.6 |
| Меншікті айналу [α]20/D | +43,0° - +50,0° | +47,5° |
| Ауыр металдар (Pb) | ≤10ppm | <10ppm |
| Кептіру кезіндегі жоғалту | ≤1,00% | 0,3% |
| Тұтану кезіндегі қалдық | ≤0,10% | 0,03% |
| Қатысты заттар | ||
| Цитозин | ≤0,10% | 0,01% |
| α-изомер | ≤0,10% | 0,01% |
| Кез келген басқа қоспалар | ≤0,10% | 0,04% |
| Жалпы қоспалар | ≤0,20% | 0,1% |
| Қалдық еріткіштер | ||
| Метанол | ≤0,30% | Анықталған жоқ |
| толуол | ≤0,01% | Анықталған жоқ |
| Дихлорметан | ≤0,01% | Анықталған жоқ |
| Ацетон | ≤0,50% | 0,1% |
| Талдау | 97,5%~101,5% (кептірілген негізде есептелген) | 99,9% |
| Қорытынды | USP35 стандартына сәйкес келеді | |
Пакет:Бөтелке, алюминий фольгадан жасалған сөмке, 25 кг / картон барабан немесе тапсырыс берушінің талабы бойынша.
Сақтау жағдайы:Контейнерді мықтап жауып, салқын, құрғақ және жақсы желдетілетін қоймада үйлесімсіз заттардан алыс сақтаңыз.Тікелей күн сәулесінің, ылғалдың және шамадан тыс қызудың әсерінен аулақ болыңыз.
Жеткізілім:FedEx / DHL Express арқылы бүкіл әлемге әуе арқылы жеткізіңіз.Жылдам және сенімді жеткізуді қамтамасыз етіңіз.


Тәуекел кодтары R21 - теріге тиген кезде зиянды
R36/38 - көзді және теріні тітіркендіреді.
R46 - Тұқым қуалайтын генетикалық зақым келтіруі мүмкін
R62 - құнарлылықтың бұзылуының ықтимал қаупі
R63 - туылмаған балаға ықтимал зиян келтіру қаупі
Қауіпсіздік сипаттамасы S25 - Көзге тигізбеңіз.
S26 - Көзге тиген жағдайда дереу көп сумен шайыңыз және дәрігерге қаралыңыз.
S36/37 - Сәйкес қорғаныс киімін және қолғапты киіңіз.
S53 - Әсер етуден аулақ болыңыз - қолданар алдында арнайы нұсқауларды алыңыз.
WGK Германия 3
RTECS HA3840000
HS коды 2942000000
Гемцитабин гидрохлориді (CAS: 122111-03-9) – метаболизмге қарсы және ісікке қарсы әсер ететін синтетикалық жаңа дифторнуклеозидті препарат.Оны Эли Лилли және Компания зерттеп, әзірледі және 1995 жылы Оңтүстік Африкада, Швецияда, Нидерландыда, Австралияда және басқа елдерде тізімге енгізуге рұқсат берді. Америка Құрама Штаттарының Азық-түлік және дәрі-дәрмек басқармасы (FDA) оны бірінші қатардағы терапия ретінде мақұлдады. өкпенің ұсақ жасушалы емес қатерлі ісігін және ұйқы безінің қатерлі ісігін клиникалық емдеуге арналған.
Соңғы жылдары Гемцитабин, Паклитаксел, Доцетаксел, Виноребин сияқты жаңа препараттар өкпенің ұсақ жасушалы емес қатерлі ісігін (қысқартылған NSCLC) емдеуге арналған тиімді препараттар болып табылады.Дәстүрлі химиотерапиялық препараттармен салыстырғанда бұл препараттардың жоғары емдік әсері мен төмен уыттылығының артықшылықтары бар.Гемцитабин гидрохлориді – метаболиттерге қарсы препараттың жаңа буыны және ДНҚ синтезі фазасында, атап айтқанда жасушалардың S фазасында маңызды рөл атқаратын жасушалық циклге арналған арнайы дәрілік зат.Белгілі бір жағдайларда бұл дәрі жасушалардың G1 фазасынан S фазасына өтуін болдырмайды және өкпенің ұсақ жасушалы емес қатерлі ісігіне (NSCLC) күшті ісікке қарсы белсенділікке ие.Шетелдік зерттеулер көрсеткендей, гемцитабин гидрохлориді бар ҰҚКЖ бір реттік емдеудің тиімділігі шамамен 18% ~ 35% құрайды, ал цисплатинмен біріктірілген емде NSCLC тиімділігі 41,7% құрайды.Жетілдірілген NSCLC кезінде карбоплатиннің тиімді жылдамдығы 16% құрайды, бұл цисплатинге ұқсас, бірақ уыттылығы төмен, әсіресе асқазан-ішек реакциялары, сүйек кемігінің басылуы және бүйрек пен жүйке ұштарының уытты реакциясы үшін.Карбоплатинмен біріктірілгенде олардың екеуі де өзара үйлестіру және аддитивті әсерге ие және жоғары емдік әсерлер тудыруы мүмкін.
Гемцитабин гидрохлориді
C9H11F2N3O4·HCl 299,66
Цитидин, 2′-дезокси-2′,2′-дифлуро-, моногидрохлорид.
2′-Деокси-2′,2′-дифтороцитидин моногидрохлориді (β-изомер) [122111-03-9].
» Гемцитабин гидрохлоридінің құрамында C9H11F2N3O4·HCl 97,5 пайыздан кем емес және 101,5 пайыздан көп емес, осы негізде есептелген.
[Сақ болыңыз – Гемцитабин гидрохлориді – күшті цитотоксикалық агент.Бөлшектердің тыныс алуына және терінің оған әсер етуіне жол бермеу үшін өте мұқият болу керек.]
Орау және сақтау - Тығыз контейнерлерде сақтаңыз.
Таңбалау - ол инъекциялық дәрілік пішіндерді дайындауда қолдануға арналған болса, затбелгіде оның стерильді екендігі немесе инъекциялық дәрілік пішіндерді дайындау кезінде әрі қарай өңдеуден өтуі керек екендігі көрсетілген.
USP анықтамалық стандарттары <11>-
USP Cytosine RS
USP Endotoxin RS
USP гемцитабин гидрохлориді РС
Сәйкестендіру-
A: Инфрақызыл сіңіру <197K>.
B: Ол хлорид <191> сынақтарының талаптарына сәйкес келеді.
Меншікті айналу <781S>: +43 пен +50 арасында, 20-да.
Сынақ ерітіндісі: 10 мг/мл.
рН <791>: 2,0 және 3,0 арасында, әрбір мл үшін 10 мг ерітіндіде.
Жану кезіндегі қалдық <281>: 0,1% артық емес.
Ауыр металдар, I әдіс <231>: 0,001%.
Хроматографиялық тазалық-
Шешім A – Талдаудағы мобильді фазаға қатысты нұсқауларды орындаңыз.
B ерітіндісі - Сүзілген және газсыздандырылған метанолды дайындаңыз.
Мобильді фаза - Хроматографиялық жүйеде көрсетілгендей А және В ерітінділерінің ауыспалы қоспаларын пайдаланыңыз.Қажет болса, түзетулер енгізіңіз (Хроматография 621 бөліміндегі Жүйе жарамдылығын қараңыз).
Жүйе жарамдылығы туралы шешім - Талдауда көрсетілгендей әрекет етіңіз.
Стандартты ерітінді - USP Gemcitabine Hydrochloride RS және USP Cytosine RS дәл өлшенген мөлшерін суда ерітіңіз және әрқайсысының мл-іне шамамен 2 мкг белгілі концентрациясы бар ерітіндіні алу үшін қажет болса, сандық және кезең-кезеңімен сұйылтыңыз.
Сынақ ерітіндісі – Нақты өлшенген шамамен 50 мг Гемцитабин гидрохлоридін 25 мл өлшемді колбаға құйыңыз, ерітіңіз және сумен көлемге дейін сұйылтыңыз және араластырыңыз.
Хроматографиялық жүйе (Хроматография 621 қараңыз) - Талдау бойынша нұсқауларды орындаңыз.Хроматограф келесідей бағдарламаланады.
Уақыт (минут) А ерітіндісі (%) В ерітіндісі (%) Элюция
0–8 97 3 изократиялық
8–13 97®50 3®50 сызықтық градиент
13–20 50 50 изократиялық
20–25 50®97 50®3 қайта теңестіру
Жүйенің жарамдылығы туралы ерітіндіні хроматографияға түсіріңіз және ең жоғары жауаптарды Процедураға сәйкес жазып алыңыз: салыстырмалы ұстау уақыты гемцитабин-аномері үшін шамамен 0,5 және гемцитабин үшін 1,0 құрайды;гемцитабин-аномер мен гемцитабин арасындағы рұқсат, R, 8,0 кем емес;ал гемцитабин үшін қалдық коэффициенті 1,5-тен аспайды.Стандартты ерітіндіні хроматографияға түсіріңіз және ең жоғары жауаптарды Процедураға сәйкес жазып алыңыз: салыстырмалы ұстау уақыты цитозин үшін шамамен 0,1 және гемцитабин үшін 1,0;қайталанатын инъекциялар үшін салыстырмалы стандартты ауытқу 2,0%-дан аспайды.
Процедура – Стандартты ерітінді мен сынақ ерітіндісінің көлемін (шамамен 20 мкл) хроматографқа бөлек енгізіңіз, хроматограмманы жазып алыңыз және барлық ең жоғары жауаптарды өлшеңіз.Гемцитабиннің алынған бөлігіндегі цитозиннің пайызын мына формула бойынша есептеңіз:
2,5(Cc/W)(rt/rs)
онда Cc стандартты ерітіндідегі USP Cytosine RS концентрациясы, мл-ге мкг;W – алынған гемцитабиннің мг-дағы салмағы;rt – Сынақ ерітіндісіндегі цитозинге ең жоғары жауап;ал rs – Стандартты ерітіндідегі цитозинге жауап: цитозиннің 0,1%-дан аспауы.Гемцитабиннің алынған бөлігіндегі цитозиннен басқа әрбір қоспаның пайызын мына формула бойынша есептеңіз:
2,5(Cs/W)(ri/rs)
онда Cs стандартты ерітіндідегі USP гемцитабин гидрохлоридінің RS концентрациясы, мл үшін мкг;W – алынған гемцитабиннің мг-дағы салмағы;ri – Сынақ ерітіндісіндегі әрбір қоспа үшін ең жоғары жауап;және rs – Стандартты ерітіндідегі гемцитабинге байланысты жауап: гемцитабин-аномердің 0,1%-дан аспауы немесе кез келген басқа жеке қоспалар табылған;ал барлық қоспалардың қосындысы 0,2%-дан аспайды.Барлық қоспалар сомасынан сандық шектеуден (0,02%) төмен кез келген шыңдарды алып тастаңыз.
Басқа талаптар - Жапсырмада Гемцитабин гидрохлоридінің стерильді екендігі көрсетілген болса, ол бактериалды эндотоксиндерге және инъекцияға арналған гемцитабиннің стерилділігіне қойылатын талаптарға сәйкес келеді.Жапсырмада Гемцитабин гидрохлориді инъекцияға арналған дәрілік формаларды дайындау кезінде әрі қарай өңдеуден өтуі керек деп жазылған болса, ол Гемцитабин инъекцияға арналған астында бактериалды эндотоксиндерге қойылатын талаптарға сәйкес келеді.
Талдау-
Жылжымалы фаза - 1000 мл суда 13,8 г мононегізді натрий фосфаты және 2,5 мл фосфор қышқылы бар сүзілген және газсыздандырылған ерітінді дайындаңыз.[ескерту-Бұл ерітіндінің рН мәні 2,4 пен 2,6 арасында.]
Жүйенің жарамдылығына арналған ерітінді – Шағын құтыға шамамен 10 мг Гемцитабин гидрохлоридін құйыңыз, бір мл метанолға 168 мг калий гидроксиді бар 4 мл ерітінді қосыңыз, қақпақты мықтап жабыңыз және ультрадыбыспен жабыңыз.6-16 сағат бойы 55 градусқа дейін қыздырыңыз, салқындатыңыз және ішіндегісін 1% (көлем/көлем) фосфор қышқылын ретімен жуу арқылы 100 мл өлшемді колбаға жіберіңіз.Көлеміне дейін 1% фосфор қышқылымен сұйылтыңыз, араластырыңыз.[ескерту-Бұл ерітіндіде гемцитабин α-аномерінің бір мл-іне шамамен 0,02 мг бар.]
Стандартты препарат - USP гемцитабин гидрохлоридінің RS дәл өлшенген мөлшерін суда ерітіңіз және белгілі концентрациясы шамамен 0,1 мг/мл болатын ерітінді алу үшін қажет болса, сумен сандық және кезең-кезеңімен сұйылтыңыз.
Талдауды дайындау – дәл өлшенген шамамен 20 мг Гемцитабин гидрохлоридін 200 мл өлшемді колбаға құйыңыз, ерітіңіз және сумен көлемге дейін сұйылтыңыз және араластырыңыз.
Хроматографиялық жүйе (Хроматография <621> қараңыз)-Сұйық хроматограф 275 нм детектормен және L7 5 мкм қаптаманы қамтитын 4,6 мм × 25 см бағанмен жабдықталған.Ағын жылдамдығы минутына шамамен 1,2 мл.Жүйенің жарамдылығы туралы ерітіндіні хроматографияға түсіріңіз және ең жоғары жауаптарды Процедураға сәйкес жазып алыңыз: гемцитабин-аномері мен гемцитабин арасындағы рұқсат, R, 8,0 кем емес;ал гемцитабиннен анықталған қалдық коэффициенті 1,5-тен аспайды.Стандартты препаратты хроматографияға түсіріңіз және ең жоғары жауаптарды Процедураға сәйкес жазып алыңыз: қайталанатын инъекциялар үшін салыстырмалы стандартты ауытқу 1,0%-дан аспайды.
Процедура – Стандартты препарат пен талдау препаратының бірдей көлемдерін (шамамен 20 мкл) хроматографқа енгізіңіз, хроматограммаларды жазып алыңыз және негізгі шыңдар үшін жауаптарды өлшеңіз.Гемцитабин гидрохлоридінің бөлігіндегі C9H11F2N3O4·HCl мөлшерін мг-мен формула бойынша есептеңіз:
200C(rU / rS)
онда C стандартты препараттағы USP гемцитабин гидрохлориді РС концентрациясы, мг/мл;және rU және rS сәйкесінше Талдау препаратынан және Стандартты препараттан алынған ең жоғары жауаптар болып табылады.
-

Гемцитабин гидрохлориді CAS 122111-03-9 API U...
-

Гемцитабин CAS 95058-81-4 талдау 98,0~102,0%
-

Цефотиам гидрохлориді CAS 66309-69-1 API USP S...
-

Доксорубицин гидрохлориді CAS 25316-40-9 API АҚШ...
-

Эналаприл малеат CAS 76095-16-4 талдау 98,0~102...
-

Гуанфацин гидрохлориді Гуанфацин HCl CAS 291...
-

Иринотекан гидрохлориді CAS 100286-90-6 Тазалық...
-

Леветирацетам LEV CAS 102767-28-2 API Factory U...
-

Налтрексон гидрохлориді CAS 16676-29-2 API USP...
-

Носкапин гидрохлориді гидраты CAS 912-60-7 AP...
-

Леводопа (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Дарунавир CAS 206361-99-1 ВИЧ-ке қарсы тазалық ≥99,0...
-

Ezetimibe CAS 163222-33-1 Тазалық 98,5%~102,0% (...
-

Ласофоксифен Тартрат CAS 190791-29-8 Хирал Пу...
-

Bortezomib CAS 179324-69-7 Тазалық ≥99,0% (HPLC)...
-

CAS 274901-16-5 Тазалық ≥99,0% (HPLC) API