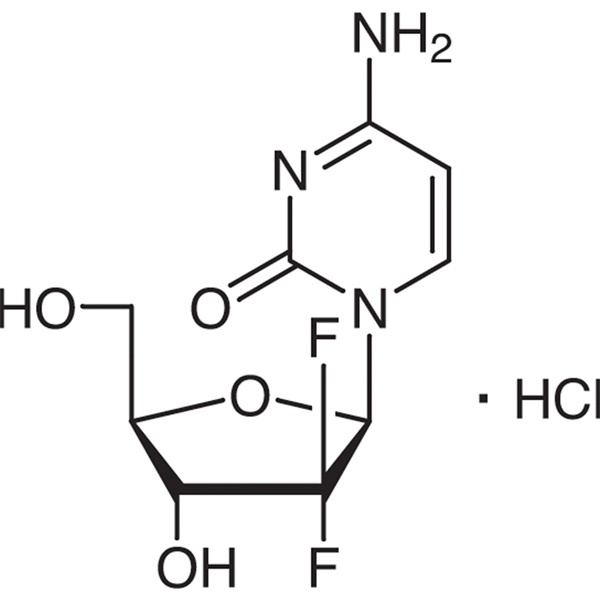
Gemcitabine 염산염 CAS 122111-03-9 API USP35 기준
Ruifu Chemical은 고품질의 상업 생산을 통해 Gemcitabine Hydrochloride(CAS: 122111-03-9)의 선두 제조업체입니다.Ruifu Chemical은 전세계 배송, 경쟁력 있는 가격, 우수한 서비스, 소량 및 대량 수량을 제공할 수 있습니다.Gemcitabine Hydrochloride 구매,Please contact: alvin@ruifuchem.com
| 화학명 | 젬시타빈 염산염 |
| 동의어 | 젬시타빈 HCl;2'-데옥시-2',2'-디플루오로시티딘 염산염;dFdC;dFdCyd;젬자르;LY188011 염산염;젬시테라;젬사르 |
| CAS 번호 | 122111-03-9 |
| 관련 CAS | 95058-81-4 - 무료 자료 |
| 재고현황 | 재고 있음, 생산 능력 5톤 |
| 분자식 | C9H12ClF2N3O4 |
| 분자 무게 | 299.66 |
| 녹는 점 | >250℃ |
| 배송 조건 | 주변 온도에서 |
| 보증서 및 MSDS | 사용 가능 |
| 기원 | 중국 상하이 |
| 상표 | 루이푸 화학 |
| 안건 | 명세서 | 결과 |
| 모습 | 백색 결정성 분말, 무취 | 준수 |
| 용해도 | 물에 용해, 메탄올에 약간 용해, 아세톤에 실질적으로 불용성 | 준수 |
| 식별 IR | IR 스펙트럼은 다음과 일치해야 합니다. 참조 표준의 것 | 준수 |
| 식별 염화물 | 긍정적인.그것은 염화물에 대한 테스트의 요구 사항을 충족합니다. | 준수 |
| 솔루션의 모습 | 명확하고 강렬하지 않은 솔루션 S 기준 용액 BY7보다 착색됨 | 준수 |
| pH | 2.0~3.0 | 2.6 |
| 특정 회전 [α]20/D | +43.0° ~ +50.0° | +47.5° |
| 중금속(Pb) | ≤10ppm | <10ppm |
| 건조감량 | ≤1.00% | 0.3% |
| 점화시 잔류물 | ≤0.10% | 0.03% |
| 관련 물질 | ||
| 시토신 | ≤0.10% | 0.01% |
| α-이성질체 | ≤0.10% | 0.01% |
| 기타 불순물 | ≤0.10% | 0.04% |
| 총 불순물 | ≤0.20% | 0.1% |
| 잔류 용매 | ||
| 메탄올 | ≤0.30% | 감지되지 않음 |
| 톨루엔 | ≤0.01% | 감지되지 않음 |
| 디클로로메탄 | ≤0.01% | 감지되지 않음 |
| 아세톤 | ≤0.50% | 0.1% |
| 시험 | 97.5%~101.5% (건조물 기준) | 99.9% |
| 결론 | USP35 표준 준수 | |
패키지:병, 알루미늄 호일 백, 25kg/Cardboard Drum, 또는 고객의 요구 사항에 따라.
보관 조건:용기를 단단히 닫고 서늘하고 건조하며 환기가 잘 되는 창고에 혼합 금지 물질과 떨어진 곳에 보관하십시오.직사광선, 습기 및 과도한 열에 노출되지 않도록 하십시오.
배송:FedEx / DHL Express를 통해 항공으로 전 세계로 배송하십시오.빠르고 안정적인 배송을 제공합니다.


위험 코드 R21 - 피부와 접촉하면 유해함
R36/38 - 눈과 피부를 자극함.
R46 - 유전 가능한 유전적 손상을 일으킬 수 있음
R62 - 불임 장애의 위험 가능성
R63 - 태아에게 해를 끼칠 가능성이 있는 위험
안전 설명 S25 - 눈에 닿지 않도록 하십시오.
S26 - 눈에 들어간 경우 즉시 다량의 물로 씻어내고 의사의 진료를 받으십시오.
S36/37 - 적절한 보호복과 장갑을 착용하십시오.
S53 - 노출을 피하십시오 - 사용하기 전에 특별 지침을 받으십시오.
WGK 독일 3
RTECS HA3840000
HS 코드 2942000000
Gemcitabine Hydrochloride(CAS: 122111-03-9)는 항대사 및 항신생물인 합성 신규 디플루오로 뉴클레오사이드 약물입니다.Eli Lilly and Company에서 연구 개발하여 1995년 남아프리카, 스웨덴, 네덜란드, 호주 등의 국가에 등재 승인을 받았습니다. 미국 식품의약국(FDA)에서 1차 치료제로 승인했습니다. 비소세포폐암 및 췌장암의 임상적 치료를 위해
최근에는 젬시타빈, 파클리탁셀, 도세탁셀, 비노레빈 등의 신약이 비소세포폐암(NSCLC로 약칭) 치료에 효과적인 약물이다.기존의 화학 요법 약물과 비교할 때 이러한 약물은 치료 효과가 높고 독성이 낮은 장점이 있습니다.젬시타빈염산염은 신세대 항대사약물이자 세포주기 특수약의 일종으로 DNA 합성기, 즉 세포의 S기에서 중요한 역할을 한다.특정 조건에서 이 약은 세포가 G1기에서 S기로 진행하는 것을 방지할 수 있으며 비소세포폐암(NSCLC)에 강력한 항암 활성을 보입니다.해외 연구에 따르면 Gemcitabine Hydrochloride만으로 NSCLC를 단독으로 치료할 경우 효율은 약 18%~35%인 반면, cisplatin과 병용할 경우 효율은 41.7%인 것으로 나타났습니다.진행된 비소세포폐암에서 카보플라틴의 유효율은 16%로 시스플라틴과 유사하지만 독성이 낮으며 특히 위장관 반응, 골수억제, 신장 및 신경말단의 독성반응에 대한 효과가 있습니다.카보플라틴과 함께 사용하면 둘 다 상호 조정 및 부가 효과가 있으며 더 높은 치료 효과를 나타낼 수 있습니다.
젬시타빈 염산염
C9H11F2N3O4·HCl 299.66
시티딘, 2'-데옥시-2',2'-디플루로-, 모노하이드로클로라이드.
2'-데옥시-2',2'-디플루오로시티딘 모노하이드로클로라이드(β-이성질체) [122111-03-9].
» 젬시타빈 염산염은 있는 그대로 계산하여 97.5% 이상 101.5% 이하의 C9H11F2N3O4·HCl을 함유합니다.
[주의-Gemcitabine Hydrochloride는 강력한 세포 독성 물질입니다.입자를 흡입하여 피부에 노출되지 않도록 각별히 주의해야 합니다.]
포장 및 보관 - 단단한 용기에 보관하십시오.
라벨링 - 주사 가능한 제형을 준비하는 데 사용되는 경우 라벨에는 멸균 상태이거나 주사 가능한 제형을 준비하는 동안 추가 처리를 거쳐야 한다고 명시되어 있습니다.
USP 참조 표준 <11>-
USP 시토신 RS
USP 내독소 RS
USP 젬시타빈 염산염 RS
신분증-
A: 적외선 흡수 <197K>.
B: 염화물<191>의 시험요건을 만족한다.
특정 회전 <781S>: 20에서 +43에서 +50 사이.
시험 용액: mL당 10mg.
pH <791>: 2.0~3.0, mL당 10mg을 포함하는 용액.
강열 잔류물 <281>: 0.1% 이하.
중금속, 방법 I <231>: 0.001%.
크로마토그래피 순도-
솔루션 A - 분석에서 이동상에 대한 지시에 따라 진행합니다.
솔루션 B - 여과 및 탈기된 메탄올을 준비합니다.
이동상-크로마토그래피 시스템의 지시에 따라 용액 A와 용액 B의 가변 혼합물을 사용합니다.필요한 경우 조정합니다(크로마토그래피 621의 시스템 적합성 참조).
시스템 적합성 솔루션 - 분석의 지시에 따라 진행합니다.
표준액-USP Gemcitabine Hydrochloride RS 및 USP Cytosine RS를 정확히 달아 물에 녹이고 필요하면 단계적으로 희석하여 각 mL당 약 2 µg의 농도를 알 수 있는 용액을 얻는다.
검액 : 이 약 약 50 mg을 정밀히 달아 25 mL 메스플라스크에 넣고 녹이고 물을 넣어 표선까지 채운 후 섞는다.
크로마토그래피 시스템(크로마토그래피 621 참조) - 정량법의 지시에 따라 진행한다.크로마토그래프는 다음과 같이 프로그래밍됩니다.
시간(분) 용액 A(%) 용액 B(%) 용출
0–8 97 3 등용매
8–13 97®50 3®50 선형 기울기
13–20 50 50 등용매
20–25 50®97 50®3 재평형
시스템 적합성 용액을 크로마토그래피하고 절차에 따라 피크 반응을 기록합니다. 상대 머무름 시간은 젬시타빈-아노머의 경우 약 0.5이고 젬시타빈의 경우 1.0입니다.젬시타빈-아노머와 젬시타빈 사이의 분해능 R은 8.0 이상이고;젬시타빈의 테일링 인자는 1.5 이하입니다.표준액을 크로마토그래피하여 시험법에 따라 피크반응을 기록한다. 상대유지시간은 시토신 약 0.1, 젬시타빈 약 1.0이다.복제 주입에 대한 상대 표준 편차는 2.0% 이하입니다.
조작-크로마토그래프에 표준액과 검액을 각각 약 20μL씩 주입하여 크로마토그램을 기록하고 피크반응을 모두 측정한다.다음 공식으로 취한 젬시타빈 부분의 시토신 백분율을 계산합니다.
2.5(Cc/W)(rt/rs)
여기서 Cc는 표준용액의 USP Cytosine RS의 농도(μg/mL)W는 복용한 젬시타빈의 중량(mg)이고;rt는 시험 용액의 사이토신에 대한 피크 반응입니다.rs는 표준용액의 시토신에 대한 반응으로 0.1% 이하의 시토신이 발견된다.젬시타빈 부분에서 시토신 이외의 각 불순물의 백분율을 다음 공식으로 계산합니다.
2.5(Cs/W)(ri/rs)
Cs : 표준용액의 USP Gemcitabine Hydrochloride RS의 농도(μg/mL)W는 복용한 젬시타빈의 중량(mg)이고;ri는 검액의 각 불순물에 대한 피크 반응이다.rs는 표준 용액에서 젬시타빈으로 인한 반응이다: 0.1% 이하의 젬시타빈-아노머 또는 임의의 다른 개별 불순물이 발견된다;모든 불순물의 합은 0.2% 이하입니다.모든 불순물의 합에서 정량 한계(0.02%) 미만인 피크를 제외합니다.
기타 요구 사항 - 라벨에 염산 젬시타빈이 무균이라고 명시되어 있는 경우 주사용 젬시타빈에 따른 박테리아 내독소 및 무균에 대한 요구 사항을 충족합니다.라벨에 염산 젬시타빈이 주사용 제형을 준비하는 동안 추가 처리를 거쳐야 한다고 명시되어 있는 경우, 젬시타빈 주사용 세균 내독소에 대한 요구 사항을 충족합니다.
시험-
이동상-인산일나트륨 13.8g 및 인산 2.5mL를 물 1000mL에 녹여 여과하고 탈기한 용액을 조제한다.[참고 - 이 용액의 pH는 2.4~2.6입니다.]
시스템 적합성 용액 - Gemcitabine Hydrochloride 약 10mg을 작은 바이알에 옮기고 메탄올 1mL당 수산화칼륨 168mg을 함유한 용액 4mL를 넣고 단단히 마개를 씌운 다음 초음파 처리합니다.55에서 6~16시간 동안 가열하고 식힌 다음 내용물을 1%(v/v) 인산으로 연속 세척하면서 100mL 용량 플라스크로 옮깁니다.1% 인산으로 부피를 희석하고 혼합한다.[참고 - 이 용액에는 mL당 약 0.02mg의 gemcitabine α-anomer가 포함되어 있습니다.]
표준품 - USP Gemcitabine Hydrochloride RS를 정확히 달아 물에 녹이고 필요하면 단계적으로 물로 희석하여 농도가 약 0.1 mg/mL인 용액을 얻는다.
조제법 - 이 약 약 20 mg을 정확하게 달아 200 mL 메스플라스크에 넣고 녹이고 물을 넣어 표선까지 희석한 후 혼합한다.
크로마토그래피 시스템(크로마토그래피 <621> 참조) - 액체 크로마토그래피에는 275nm 검출기와 5µm 패킹 L7이 포함된 4.6mm × 25cm 컬럼이 장착되어 있습니다.유속은 분당 약 1.2mL입니다.시스템 적합성 용액을 크로마토그래피하고 절차에 따라 피크 반응을 기록합니다. 젬시타빈-아노머와 젬시타빈 사이의 분해능 R은 8.0 이상입니다.젬시타빈에서 결정된 테일링 인자는 1.5 이하입니다.표준품을 크로마토그래피하고 절차에 따라 피크 반응을 기록합니다. 복제 주입에 대한 상대 표준 편차는 1.0% 이하입니다.
절차 - 표준품과 검정액을 같은 양(약 20μL)씩 크로마토그래프에 각각 주입하고 크로마토그램을 기록하고 주요 피크에 대한 반응을 측정합니다.다음 공식에 따라 젬시타빈 염산염 부분에서 C9H11F2N3O4·HCl의 양(mg)을 계산하십시오.
200C(rU / rS)
C : 표준품 중의 USP Gemcitabine Hydrochloride RS의 농도(mg/mL)rU 및 rS는 각각 Assay 준비 및 표준 준비에서 얻은 피크 응답입니다.
-

Gemcitabine 염산염 CAS 122111-03-9 API U...
-

Gemcitabine CAS 95058-81-4 분석실험 98.0~102.0%
-

Cefotiam 염산염 CAS 66309-69-1 API USP S...
-

독소루비신 염산염 CAS 25316-40-9 API US...
-

Enalapril Maleate CAS 76095-16-4 분석 98.0~102...
-

Guanfacine 염산염 Guanfacine HCl CAS 291...
-

이리노테칸 염산염 CAS 100286-90-6 순도...
-

Levetiracetam LEV CAS 102767-28-2 API 공장 U...
-

날트렉손 염산염 CAS 16676-29-2 API USP...
-

Noscapine 염산염 수화물 CAS 912-60-7 AP...
-

레보도파(L-DOPA) CAS 59-92-7 99.0~100.5% USP B...
-

Darunavir CAS 206361-99-1 항 HIV 순도 ≥99.0...
-

Ezetimibe CAS 163222-33-1 순도 98.5%~102.0%(...
-

Lasofoxifene Tartrate CAS 190791-29-8 키랄 PU ...
-

Bortezomib CAS 179324-69-7 순도 ≥99.0%(HPLC)...
-

CAS 274901-16-5 순도 ≥99.0%(HPLC) API