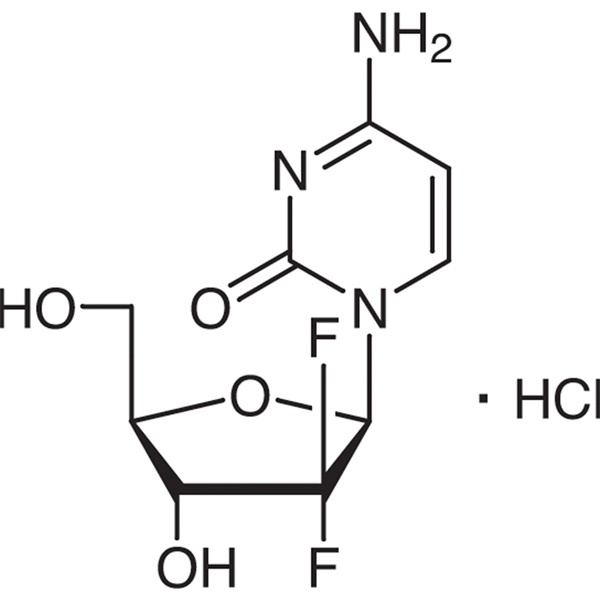
Гемцитабин гидрохлориди CAS 122111-03-9 API USP35 стандарты
Ruifu Chemical жогорку сапаттагы, соода өндүрүшү менен Gemcitabine гидрохлоридинин (CAS: 122111-03-9) алдыңкы өндүрүүчүсү болуп саналат.Ruifu Chemical дүйнө жүзү боюнча жеткирүү, атаандаштыкка жөндөмдүү бааны, мыкты тейлөөнү, кичинекей жана жапырт көлөмдө камсыз кыла алат.Гемцитабин гидрохлориди сатып алуу,Please contact: alvin@ruifuchem.com
| Химиялык аты | Гемцитабин гидрохлориди |
| Синонимдер | Гемцитабин HCl;2'-дезокси-2',2'-дифтороцитидин гидрохлориди;dFdC;dFdCyd;Gemzar;LY188011 Гидрохлорид;Gemcitera;Gemsar |
| CAS номери | 122111-03-9 |
| Тиешелүү CAS | 95058-81-4 - Акысыз база |
| Запастын абалы | Запаста, өндүрүштүк кубаттуулугу 5 тонна |
| Молекулярдык формула | C9H12ClF2N3O4 |
| Молекулярдык Салмак | 299.66 |
| Эрүү чекити | >250℃ |
| Жеткирүү абалы | Курчап турган чөйрөнүн температурасы астында |
| COA & MSDS | жеткиликтүү |
| Origin | Шанхай, Кытай |
| Бренд | Ruifu Chemical |
| пункт | Техникалык шарттар | Жыйынтыктар |
| Көрүнүш | Ак кристаллдык порошок, жытсыз | ылайык келет |
| Эригичтик | Сууда эрийт, метанолдо бир аз эрийт, иш жүзүндө ацетондо эрибейт | ылайык келет |
| Идентификациялоо IR | IR спектри дал келиши керек эталондук стандартка тиешелүү | ылайык келет |
| Идентификациялык хлорид | Позитивдүү.Бул хлорид боюнча сыноолордун талаптарына жооп берет | ылайык келет |
| Чечимдин көрүнүшү | Чечим S ачык-айкын жана күчтүү эмес BY7 эталондук эритмеге караганда түстүү | ылайык келет |
| pH | 2,0~3,0 | 2.6 |
| Өзгөчө айлануу [α]20/D | +43,0°тан +50,0°ка чейин | +47,5° |
| Оор металлдар (Pb) | ≤10ppm | <10ppm |
| Кургатуудагы жоготуу | ≤1,00% | 0,3% |
| От алдыруудагы калдык | ≤0,10% | 0,03% |
| Байланыштуу заттар | ||
| цитозин | ≤0,10% | 0,01% |
| α-изомер | ≤0,10% | 0,01% |
| Башка ыпластыктар | ≤0,10% | 0,04% |
| Жалпы аралашмалар | ≤0,20% | 0,1% |
| Калдык эриткичтер | ||
| Метанол | ≤0,30% | Табылган жок |
| толуол | ≤0,01% | Табылган жок |
| Дихлорметан | ≤0,01% | Табылган жок |
| Ацетон | ≤0,50% | 0,1% |
| Талдоо | 97,5% ~ 101,5% (кургатылган негиз боюнча эсептелген) | 99,9% |
| Корутунду | USP35 стандартына ылайык келет | |
Пакет:Бөтөлкө, алюминий фольга баштык, 25 кг / картон барабан, же кардардын талабы боюнча.
Сактоо шарты:Контейнерди бекем жаап, салкын, кургак жана жакшы желдетилген кампада бири-бирине туура келбеген заттардан алыс сактаңыз.Тике күн нурунун, нымдуулуктун жана ашыкча ысыктын таасиринен алыс болуңуз.
Жеткирүү:FedEx / DHL Express аркылуу дүйнө жүзү боюнча аба аркылуу жеткирүү.Тез жана ишенимдүү жеткирүү менен камсыз кылуу.


Risk Codes R21 - Тери менен тийгенде зыяндуу
R36/38 - Көздү жана терини дүүлүктүрүүчү.
R46 - тукум куума генетикалык зыян алып келиши мүмкүн
R62 - Төрөттүн бузулушунун мүмкүн болгон коркунучу
R63 - төрөлө элек балага зыян келтирүүнүн мүмкүн болгон коркунучу
Коопсуздук Сүрөттөмөсү S25 - Көзгө тийбеңиз.
S26 - Көзгө тийген учурда дароо көп суу менен жууп, дарыгерге кайрылыңыз.
S36/37 - Ылайыктуу коргоочу кийимдерди жана кол каптарды кийиңиз.
S53 - Экспозициядан качыңыз - колдонуудан мурун атайын нускамаларды алыңыз.
WGK Германия 3
RTECS HA3840000
HS коду 2942000000
Gemcitabine Hydrochloride (CAS: 122111-03-9) анти-метаболикалык жана антинеопластик болуп саналат синтетикалык романы difluoronucleoside дары болуп саналат.Бул Eli Lilly and Company тарабынан изилденген жана иштелип чыккан жана 1995-жылы Түштүк Африкада, Швецияда, Нидерландыда, Австралияда жана башка өлкөлөрдө тизмеге кирүүгө бекитилген. Америка Кошмо Штаттарынын Азык-түлүк жана дары-дармек башкармалыгы (FDA) аны биринчи катардагы терапия катары бекиткен. кичинекей клеткалык эмес өпкө рагын жана уйку безинин рагын клиникалык дарылоо үчүн.
Акыркы жылдарда Гемцитабин, Паклитаксел, Доцетаксел, Виноребин сыяктуу жаңы дарылар өпкөнүн майда эмес клеткалуу рагын (кыскартылган NSCLC) дарылоо үчүн эффективдүү дарылар болуп саналат.Салттуу химиотерапиялык препараттар менен салыштырганда, бул дары-дармектер жогорку дарылоочу эффектилердин жана аз уулуулуктун артыкчылыктарына ээ.Гемцитабин гидрохлориди – метаболиттерге каршы жаңы муундагы дары жана ДНК синтезинин фазасында, тактап айтканда, клеткалардын S фазасында негизги ролду ойногон клетка цикли үчүн атайын дары түрү.Белгилүү шарттарда, бул дары клеткалардын G1 фазасынан S фазасына өтүшүн алдын алат жана өпкөнүн кичинекей клеткалуу рак оорусуна каршы күчтүү активдүүлүккө ээ.Чет элдик изилдөөлөр көрсөткөндөй, гемцитабин гидрохлориди менен КБККны бир жолку дарылоонун эффективдүүлүгү болжол менен 18% ~ 35% түзөт, ал эми цисплатин менен айкалыштырылган дарылоонун эффективдүүлүгү 41,7% түзөт.Өркүндөтүлгөн NSCLCде карбоплатиндин эффективдүү көрсөткүчү 16% түзөт, ал цисплатинге окшош, бирок аз уулуулугуна ээ, айрыкча ашказан-ичеги-карын ооруларында, жилик чучугунун басылышында жана бөйрөктүн жана нерв учтарынын уулуу реакциясында.Карбоплатин менен бирге алардын экөө тең өз ара координациялоочу жана кошумча эффектке ээ жана жогорку дарылоочу эффекттерди бере алат.
Гемцитабин гидрохлориди
C9H11F2N3O4·HCl 299,66
Цитидин, 2′-дезокси-2′,2′-дифлуро-, моногидрохлорид.
2′-Деокси-2′,2′-дифтороцитидин моногидрохлориди (β-изомер) [122111-03-9].
» Гемцитабин гидрохлоридинин курамында C9H11F2N3O4·HCl 97,5 пайыздан кем эмес жана 101,5 пайыздан көп эмес, негизи боюнча эсептелген.
[Эскертүү-Гемцитабин гидрохлориди күчтүү цитотоксик агент.Бөлүкчөлөрдү дем алуу жана терини ага тийгизбөө үчүн өтө кылдаттык менен мамиле кылуу керек.]
Таңгактоо жана сактоо - бекем идиштерде сактаңыз.
этикеткалоо - бул инъекциялык дозалоо формаларын даярдоодо колдонуу үчүн арналган жерде, этикетка стерилдүү же инъекциялык дозалык формаларды даярдоодо андан ары кайра иштетүүгө дуушар болушу керек деп айтылат.
USP Reference стандарттары <11>-
USP Cytosine RS
USP Endotoxin RS
USP Gemcitabine Hydrochloride RS
Идентификация -
A: Infrared Абсорбция <197K>.
B: Бул Хлорид <191> үчүн сыноолордун талаптарына жооп берет.
Өзгөчө айлануу <781S>: +43 жана +50 ортосунда, 20да.
Сыноо эритмеси: 10 мг/ мл.
рН <791>: 2,0 жана 3,0 ортосунда, 1 мл 10 мг камтыган эритмеде.
От алдыруудагы калдык <281>: 0,1% дан көп эмес.
Оор металлдар, Метод I <231>: 0,001%.
Хроматографиялык тазалык -
Чечим A - Анализдин Мобилдик фазасында көрсөтүлгөндөй улантыңыз.
B чечими - чыпкаланган жана газсыздандырылган метанолду даярдаңыз.
Мобилдик фаза - Хроматографиялык тутумда көрсөтүлгөндөй А жана В эритменин өзгөрүлмө аралашмаларын колдонуңуз.Зарыл болсо, оңдоолорду киргизиңиз (Хроматография 621 астында тутумдун ылайыктуулугун караңыз).
Системанын ылайыктуулугу чечими - Анализде көрсөтүлгөндөй улантыңыз.
Стандарттык эритме - USP Gemcitabine Hydrochloride RS жана USP Cytosine RS дын так таразаланган көлөмүн сууда эритип, ар бир мл үчүн болжол менен 2 мкг белгилүү концентрацияга ээ эритмени алуу үчүн сандык жана зарыл болсо этап менен суюлтуңуз.
Сыноочу эритме - 50 мг жакын Гемцитабин гидрохлоридин, так таразага салып, 25 мл өлчөмдүү колбага салып, ээритип, суу менен көлөмгө чейин суюлтуңуз жана аралаштырыңыз.
Хроматографиялык система (621 хроматографияны караңыз) - Анализге ылайык иш кылыңыз.Хроматограф төмөнкүдөй программаланган.
Убакыт (мүнөт) А чечими (%) Б эритмеси (%) Элюция
0–8 97 3 изократиялык
8–13 97®50 3®50 сызыктуу градиент
13–20 50 50 изократиялык
20–25 50®97 50®3 кайра тең салмактуулук
Системанын ылайыктуулугу боюнча эритмени хроматографиядан өткөрүңүз жана Процедурада көрсөтүлгөндөй эң жогорку жоопторду жазыңыз: салыштырмалуу кармап калуу убактысы гемцитабин-аномер үчүн болжол менен 0,5 жана гемцитабин үчүн 1,0;резолюция, R, гемцитабин-аномер менен гемцитабиндин ортосундагы 8,0 кем эмес;ал эми гемцитабин үчүн калдык фактору 1,5тен көп эмес.Стандарттык эритмени хроматографиядан өткөрүңүз жана эң жогорку жоопторду Процедурада көрсөтүлгөндөй жазыңыз: салыштырмалуу кармоо убакыттары цитозин үчүн 0,1 жана гемцитабин үчүн 1,0;репликативдүү инъекциялар үчүн салыштырмалуу стандарттык четтөө 2,0% дан көп эмес.
Процедура – Стандарттык эритменин жана Сыноочу эритменин көлөмүн (болжол менен 20 мкл) хроматографка өзүнчө сайыңыз, хроматограмманы жазыңыз жана эң жогорку жоопторду өлчөңүз.Гемцитабиндин үлүшүндөгү цитозиндин пайызын формула менен эсептеңиз:
2,5(Cc/W)(rt/rs)
мында Cc стандарттык эритмедеги USP Cytosine RS концентрациясы, мл үчүн мкг менен;W - алынган гемцитабиндин салмагы, мг менен;rt – Сыноодогу эритмедеги цитозин үчүн эң жогорку жооп;жана rs - Стандарттык эритмеде цитозин үчүн жооп: цитозиндин 0,1% ашпаганы табылат.Гемцитабиндин үлүшүндөгү цитозинден башка ар бир аралашманын пайызын формула боюнча эсептеңиз:
2,5(Cs/W)(ri/rs)
мында Cs стандарттык эритмедеги USP гемцитабин гидрохлоридинин RS концентрациясы, мл үчүн мкг менен;W - алынган гемцитабиндин салмагы, мг менен;ri - Сыноочу эритмедеги ар бир ыпластык үчүн эң жогорку жооп;жана rs - Стандарттык эритмеде гемцитабинге байланыштуу жооп: 0,1% дан ашык эмес гемцитабин-аномер же кандайдыр бир башка жеке аралашма табылган;жана бардык аралашмалардын суммасы 0,2% дан ашык эмес.Бардык аралашмалардын суммасынан сан чегинен (0,02%) төмөн болгон чокуларды алып салыңыз.
Башка талаптар - Гемцитабин гидрохлоридинин этикеткасында стерилдүү деп жазылган болсо, ал бактериялык эндотоксиндерге жана инъекция үчүн гемцитабиндин стерилдүүлүгүнө карата талаптарга жооп берет.Эгерде этикеткада Гемцитабин гидрохлориди инъекциялык дозалоо формаларын даярдоодо андан ары кайра иштетүүгө дуушар болушу керек деп жазылган болсо, ал Гемцитабин инъекциясына ылайык бактериалдык эндотоксиндерге коюлган талаптарга жооп берет.
Анализ-
Мобилдик фаза - 1000 мл сууда 13,8 г мононегиздик натрий фосфаты жана 2,5 мл фосфор кислотасы бар чыпкаланган жана газсыздандырылган эритмени даярдаңыз.[Эскертүү-Бул эритменин рН 2,4 жана 2,6 ортосунда.]
Системанын ылайыктуу чечими - Гемцитабин гидрохлоридинин 10 мг жакынын кичинекей флаконго өткөрүп, 4 мл метанолго 168 мг калий гидроксиди камтыган эритмени кошуп, капкагын бекем жаап, ультрадыбыс менен бекитиңиз.55 градуска чейин 6—16 саат ысытыңыз, муздатыңыз жана ичиндегини 1% (көлөм/көлөм) фосфор кислотасын ырааттуу жууп, 100 мл өлчөмдүү колбага коюңуз.1% фосфор кислотасы менен көлөмгө чейин эритип, аралаштырабыз.[Эскертүү-Бул чечим гемцитабин α-аномердин 1 мл 0,02 мг жөнүндө камтыйт.]
Стандарттык препарат - USP Gemcitabine Hydrochloride RS дын так таразаланган өлчөмүн сууда эритип, сандык жана зарыл болсо, суу менен 0,1 мг/ мл белгилүү концентрацияга ээ эритмени алуу үчүн суюлтуңуз.
Анализди даярдоо - 20 мг жакын Гемцитабин гидрохлоридин, так таразага салып, 200 мл өлчөмдүү колбага салып, эритип, суу менен көлөмгө чейин суюлтуңуз жана аралаштырыңыз.
Хроматографиялык система (караңыз: Хроматография <621>) - Суюк хроматограф 275 нм детектор жана 4,6 мм × 25 см мамыча менен жабдылган, анда 5 мкм таңгак L7 камтылган.агымынын ылдамдыгы мүнөтүнө болжол менен 1,2 мл.Системанын ылайыктуулугу боюнча эритмени хроматографиядан өткөрүңүз жана Процедурада көрсөтүлгөндөй эң жогорку жоопторду жазыңыз: резолюция, R, гемцитабин-аномер менен гемцитабиндин ортосундагы 8,0 кем эмес;ал эми гемцитабинден аныкталган калдык фактору 1,5тен көп эмес.Стандарттык препаратты хроматографиядан өткөрүңүз жана Процедурада көрсөтүлгөндөй эң жогорку жоопторду жазыңыз: кайталанма инъекциялар үчүн салыштырмалуу стандарттык четтөө 1,0% дан көп эмес.
Процедура – Стандарттык препарат менен Анализ препаратынын бирдей көлөмүн (болжол менен 20 мкл) хроматографка өзүнчө сайыңыз, хроматограммаларды жазыңыз жана негизги чокулар үчүн жоопторду өлчөңүз.Гемцитабин гидрохлоридинин үлүшүндөгү C9H11F2N3O4·HClдин мг менен санын формула менен эсептеңиз:
200C(rU / rS)
мында С стандарттык препараттагы USP Gemcitabine Hydrochloride RS концентрациясы, мг/мл;жана rU жана rS тиешелүүлүгүнө жараша Анализдик препараттан жана Стандарттык препараттан алынган эң жогорку жооптор.
-

Гемцитабин гидрохлориди CAS 122111-03-9 API U...
-

Гемцитабин CAS 95058-81-4 Анализ 98,0~102,0%
-

Cefotiam гидрохлориди CAS 66309-69-1 API USP S...
-

Доксорубицин гидрохлориди CAS 25316-40-9 API АКШ...
-

Эналаприл Малеат CAS 76095-16-4 Анализ 98.0~102...
-

Гуанфацин гидрохлориди Гуанфацин HCl CAS 291...
-

Иринотекан гидрохлориди CAS 100286-90-6 тазалык...
-

Леветирацетам LEV CAS 102767-28-2 API Factory U...
-

Налтрексон гидрохлориди CAS 16676-29-2 API USP...
-

Носкапин гидрохлорид гидраты CAS 912-60-7 AP...
-

Леводопа (L-DOPA) CAS 59-92-7 99.0 ~ 100.5% USP B...
-

Darunavir CAS 206361-99-1 ВИЧке каршы тазалык ≥99.0...
-

Ezetimibe CAS 163222-33-1 Тазалык 98,5%~102,0% (...
-

Lasofoxifen Tartrate CAS 190791-29-8 Chiral Pu...
-

Bortezomib CAS 179324-69-7 Тазалык ≥99,0% (HPLC)...
-

CAS 274901-16-5 Purity ≥99,0% (HPLC) API