Gemcitabīna hidrohlorīds CAS 122111-03-9 API USP35 standarts
Ruifu Chemical ir vadošais gemcitabīna hidrohlorīda (CAS: 122111-03-9) ražotājs ar augstas kvalitātes komerciālu ražošanu.Ruifu Chemical var nodrošināt piegādi visā pasaulē, konkurētspējīgu cenu, lielisku servisu, mazus un lielapjoma daudzumus.Iegādājieties gemcitabīna hidrohlorīdu,Please contact: alvin@ruifuchem.com
| Ķīmiskais nosaukums | Gemcitabīna hidrohlorīds |
| Sinonīmi | Gemcitabīna HCl;2'-deoksi-2',2'-difluorocitidīna hidrohlorīds;dFdC;dFdCyd;Gemzar;LY188011 hidrohlorīds;Gemcitera;Gemsar |
| CAS numurs | 122111-03-9 |
| Saistītā CAS | 95058-81-4 — brīvā bāze |
| Noliktavas statuss | Noliktavā, ražošanas jauda 5 tonnas |
| Molekulārā formula | C9H12ClF2N3O4 |
| Molekulārais svars | 299,66 |
| Kušanas punkts | >250 ℃ |
| Piegādes stāvoklis | Zem apkārtējās vides temperatūras |
| COA un MSDS | Pieejams |
| Izcelsme | Šanhaja, Ķīna |
| Zīmols | Ruifu ķīmiskā viela |
| Lieta | Specifikācijas | Rezultāti |
| Izskats | Balts kristālisks pulveris, bez smaržas | Atbilst |
| Šķīdība | Šķīst ūdenī, nedaudz šķīst metanolā, praktiski nešķīst acetonā | Atbilst |
| Identifikācijas IR | IR spektram ir jāatbilst standarta standarts | Atbilst |
| Identifikācija Hlorīds | Pozitīvi.Tas atbilst hlorīda testu prasībām | Atbilst |
| Šķīduma izskats | Šķīdums S ir skaidrs un ne intensīvāks krāsaināks nekā standartšķīdums BY7 | Atbilst |
| pH | 2,0–3,0 | 2.6 |
| Īpatnējā rotācija [α]20/D | +43,0° līdz +50,0° | +47,5° |
| Smagie metāli (Pb) | ≤10 ppm | <10 ppm |
| Zudumi žāvējot | ≤1,00% | 0,3% |
| Atlikums uz aizdedzes | ≤0,10% | 0,03% |
| Saistītās vielas | ||
| Citozīns | ≤0,10% | 0,01% |
| α-izomērs | ≤0,10% | 0,01% |
| Jebkurš cits piemaisījums | ≤0,10% | 0,04% |
| Kopējie piemaisījumi | ≤0,20% | 0,1% |
| Atlikušie šķīdinātāji | ||
| Metanols | ≤0,30% | Nav atklāts |
| Toluols | ≤0,01% | Nav atklāts |
| Dihlormetāns | ≤0,01% | Nav atklāts |
| Acetons | ≤0,50% | 0,1% |
| Pārbaude | 97,5% ~ 101,5% (aprēķinot uz žāvētas bāzes) | 99,9% |
| Secinājums | Atbilst USP35 standartam | |
Iepakojums:Pudele, alumīnija folijas maisiņš, 25 kg / kartona bungas vai atbilstoši klienta prasībām.
Uzglabāšanas stāvoklis:Glabāt konteineru cieši noslēgtu un uzglabāt vēsā, sausā un labi vēdināmā noliktavā prom no nesaderīgām vielām.Izvairieties no tiešas saules gaismas, mitruma un pārmērīga karstuma.
Piegāde:Piegādājiet visā pasaulē ar gaisa transportu, izmantojot FedEx/DHL Express.Nodrošiniet ātru un uzticamu piegādi.


Riska kodi R21 - Kaitīgs, nonākot saskarē ar ādu
R36/38 - Kairina acis un ādu.
R46 - Var izraisīt iedzimtus ģenētiskus bojājumus
R62 - Iespējams traucētas auglības risks
R63 - Iespējams kaitējuma risks nedzimušam bērnam
Drošības apraksts S25 - Izvairīties no saskares ar acīm.
S26 - Ja nokļūst acīs, nekavējoties tās skalot ar lielu daudzumu ūdens un meklēt medicīnisku palīdzību.
S36/37 - Valkājiet piemērotu aizsargapģērbu un cimdus.
S53 - Izvairieties no iedarbības - pirms lietošanas iegūt īpašus norādījumus.
WGK Vācija 3
RTECS HA3840000
HS kods 2942000000
Gemcitabīna hidrohlorīds (CAS: 122111-03-9) ir sintētisks jauns difluornukleozīdu medikaments, kas ir pretmetabolisks un pretaudzēju līdzeklis.To ir izpētījis un izstrādājis Eli Lilly and Company, un 1995. gadā tas ir apstiprināts iekļaušanai Dienvidāfrikas, Zviedrijas, Nīderlandes, Austrālijas un citu valstu sarakstā. Amerikas Savienoto Valstu Pārtikas un zāļu pārvalde (FDA) to apstiprināja kā pirmās līnijas terapiju. nesīkšūnu plaušu vēža un aizkuņģa dziedzera vēža klīniskai ārstēšanai.
Pēdējos gados jaunas zāles, piemēram, gemcitabīns, paklitaksels, docetaksels, vinorebīns, ir efektīvas zāles nesīkšūnu plaušu vēža (saīsināti NSCLC) ārstēšanai.Salīdzinot ar tradicionālajām ķīmijterapijas zālēm, šīm zālēm ir augsta ārstnieciskā iedarbība un zema toksicitāte.Gemcitabine Hydrochloride ir jaunas paaudzes pretmetabolītu zāles un īpašu zāļu veids šūnu ciklam, kam ir liela nozīme DNS sintēzes fāzē, proti, šūnu S fāzē.Noteiktos apstākļos šīs zāles var novērst šūnu progresēšanu no G1 fāzes uz S fāzi, un tām ir spēcīga pretvēža aktivitāte nesīkšūnu plaušu vēzim (NSCLC).Ārvalstu pētījumi ir parādījuši, ka vienreizējas NSŠPV ārstēšanas efektivitāte, izmantojot tikai gemcitabīna hidrohlorīdu, ir aptuveni 18% ~ 35%, savukārt, kombinējot ārstēšanu ar cisplatīnu, NSCLC efektivitāte ir 41,7%.Progresējošas NSŠPV gadījumā efektīvais karboplatīna līmenis ir 16%, kas ir līdzīgs cisplatīnam, taču tam ir zema toksicitāte, īpaši attiecībā uz kuņģa-zarnu trakta reakcijām, kaulu smadzeņu nomākumu un nieru un nervu galu toksisko reakciju.Kombinācijā ar karboplatīnu abiem ir savstarpēja koordinācija un aditīva iedarbība, un tie var radīt lielāku ārstniecisko efektu.
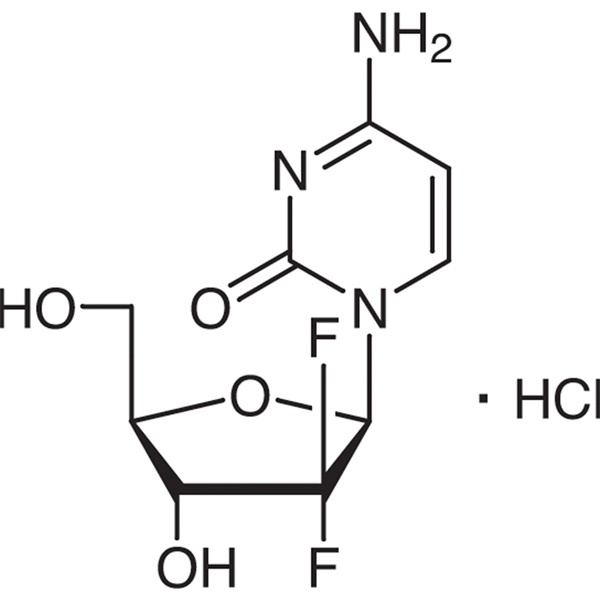
Gemcitabīna hidrohlorīds
C9H11F2N3O4·HCl 299,66
Citidīns, 2′-deoksi-2′,2′-difluor-, monohidrohlorīds.
2′-deoksi-2′,2′-difluorocitidīna monohidrohlorīds (β-izomērs) [122111-03-9].
» Gemcitabīna hidrohlorīds satur ne mazāk kā 97,5 procentus un ne vairāk kā 101,5 procentus C9H11F2N3O4·HCl, aprēķina, pamatojoties uz tādu pašu.
[Uzmanību! Gemcitabīna hidrohlorīds ir spēcīgs citotoksisks līdzeklis.Jāievēro liela piesardzība, lai nepieļautu daļiņu ieelpošanu un ādas pakļaušanu tām.]
Iepakojums un uzglabāšana - Uzglabāt cieši noslēgtos konteineros.
Marķējums — ja tas ir paredzēts lietošanai injicējamo zāļu formu gatavošanā, uz etiķetes ir norādīts, ka tas ir sterils vai ir jāpakļauj turpmākai apstrādei injicējamo zāļu formu sagatavošanas laikā.
USP atsauces standarti <11>-
USP Cytosine RS
USP Endotoksīns RS
USP Gemcitabine Hydrochloride RS
Identifikācija-
A: Infrasarkanā starojuma absorbcija <197K>.
B: tas atbilst hlorīda <191> testu prasībām.
Īpatnējā rotācija <781S>: no +43 līdz +50, pie 20.
Testa šķīdums: 10 mg uz ml.
pH <791>: no 2,0 līdz 3,0 šķīdumā, kas satur 10 mg/ml.
Aizdedzes atlikums <281>: ne vairāk kā 0,1%.
Smagie metāli, I metode <231>: 0,001%.
Hromatogrāfiskā tīrība -
Risinājums A – rīkojieties, kā norādīts testa mobilajā fāzē.
Šķīdums B. Sagatavojiet filtrētu un degazētu metanolu.
Mobilā fāze — izmantojiet šķīduma A un šķīduma B mainīgos maisījumus, kā norādīts sadaļā Hromatogrāfiskā sistēma.Ja nepieciešams, veiciet pielāgojumus (skatiet Sistēmas piemērotību sadaļā Chromatography 621).
Sistēmas piemērotības risinājums — rīkojieties, kā norādīts pārbaudē.
Standarta šķīdums – precīzi nosvērtu USP Gemcitabine Hydrochloride RS un USP Cytosine RS daudzumu izšķīdina ūdenī un kvantitatīvi atšķaida un, ja nepieciešams, pakāpeniski, lai iegūtu šķīdumu, kura zināmā koncentrācija ir aptuveni 2 µg uz ml katra.
Testa šķīdums. Pārnes apmēram 50 mg precīzi nosvērta gemcitabīna hidrohlorīda 25 ml mērkolbā, izšķīdina un atšķaida ar ūdeni līdz tilpumam un samaisa.
Hromatogrāfiskā sistēma (skatīt Chromatography 621) — rīkojieties, kā norādīts sadaļā Pārbaude.Hromatogrāfs ir ieprogrammēts šādi.
Laiks (minūtes) Šķīdums A (%) Šķīdums B (%) Elucija
0–8 97 3 izokrātisks
8–13 97®50 3®50 lineārais gradients
13–20 50 50 izokrātisks
20–25 50®97 50®3 līdzsvara atjaunošana
Veiciet sistēmas piemērotības šķīduma hromatogrāfiju un pierakstiet maksimālās atbildes reakcijas, kā norādīts procedūrā: relatīvie aiztures laiki ir aptuveni 0,5 gemcitabīna anomēram un 1,0 gemcitabīnam;izšķirtspēja R starp gemcitabīna anomēru un gemcitabīnu nav mazāka par 8,0;un gemcitabīna atkrituma koeficients nav lielāks par 1,5.Hromatografējiet standarta šķīdumu un pierakstiet maksimālās atbildes reakcijas, kā norādīts procedūrā: relatīvie aiztures laiki ir aptuveni 0,1 citozīnam un 1,0 gemcitabīnam;relatīvā standarta novirze atkārtotām injekcijām nav lielāka par 2,0%.
Procedūra – hromatogrāfā atsevišķi injicējiet standarta šķīduma un testa šķīduma tilpumu (apmēram 20 µL), pierakstiet hromatogrammu un izmēra visas maksimālās atbildes reakcijas.Aprēķiniet citozīna procentuālo daudzumu gemcitabīna daļā, kas ņemta pēc formulas:
2,5 (Cc/W) (rt/rs)
kurā Cc ir USP citozīna RS koncentrācija standarta šķīdumā, µg/ml;W ir uzņemtā gemcitabīna svars mg;rt ir maksimālā reakcija uz citozīnu testa šķīdumā;un rs ir reakcija uz citozīnu standarta šķīdumā: tiek konstatēts ne vairāk kā 0,1% citozīna.Aprēķiniet katra piemaisījuma, izņemot citozīnu, procentuālo daudzumu gemcitabīna daļā, ko ņem pēc formulas:
2,5 (Cs/W)(ri/rs)
kurā Cs ir USP Gemcitabine Hydrochloride RS koncentrācija standarta šķīdumā, µg/ml;W ir uzņemtā gemcitabīna svars mg;ri ir katra testa šķīduma piemaisījuma maksimālā reakcija;un rs ir gemcitabīna reakcija standarta šķīdumā: nav atrasts vairāk kā 0,1% gemcitabīna anomēra vai kāds cits atsevišķs piemaisījums;un visu piemaisījumu summa nav lielāka par 0,2%.No visu piemaisījumu summas izslēdz visus maksimumus, kas ir zem kvantitatīvās noteikšanas robežas (0,02%).
Citas prasības — ja uz etiķetes ir norādīts, ka gemcitabīna hidrohlorīds ir sterils, tas atbilst prasībām par baktēriju endotoksīniem un sterilitāti saskaņā ar gemcitabīna injekcijām.Ja uz etiķetes ir norādīts, ka gemcitabīna hidrohlorīds ir jāpakļauj turpmākai apstrādei injicējamo zāļu formu sagatavošanas laikā, tas atbilst gemcitabīna injekcijām prasībām attiecībā uz baktēriju endotoksīniem.
Pārbaude-
Mobilā fāze — pagatavo filtrētu un degazētu šķīdumu, kas satur 13,8 g vienbāziskā nātrija fosfāta un 2,5 ml fosforskābes 1000 ml ūdens.[piezīme. Šī šķīduma pH ir no 2,4 līdz 2,6.]
Sistēmas piemērotības šķīdums — pārnesiet apmēram 10 mg gemcitabīna hidrohlorīda nelielā flakonā, pievienojiet 4 ml šķīduma, kas satur 168 mg kālija hidroksīda uz ml metanola, cieši aizveriet vāciņu un apstrādājiet to ar ultraskaņu.Karsē 55 °C 6 līdz 16 stundas, ļauj atdzist un pārnes saturu uz 100 ml mērkolbu, secīgi mazgājot ar 1 % (v/v) fosforskābi.Atšķaida ar 1% fosforskābi līdz tilpumam un samaisa.[piezīme. Šis šķīdums satur apmēram 0,02 mg uz ml gemcitabīna α-anomēra.]
Standarta preparāts – precīzi nosvērtu USP Gemcitabine Hydrochloride RS daudzumu izšķīdina ūdenī un kvantitatīvi un, ja nepieciešams, pakāpeniski atšķaida ar ūdeni, lai iegūtu šķīdumu, kura zināmā koncentrācija ir aptuveni 0,1 mg/ml.
Testa sagatavošana. Pārnes apmēram 20 mg precīzi nosvērta gemcitabīna hidrohlorīda uz 200 ml mērkolbu, izšķīdina un atšķaida ar ūdeni līdz tilpumam un samaisa.
Hromatogrāfiskā sistēma (sk. Hromatogrāfija <621>) — Šķidruma hromatogrāfs ir aprīkots ar 275 nm detektoru un 4,6 mm × 25 cm kolonnu, kas satur 5 µm iepakojumu L7.Plūsmas ātrums ir aptuveni 1,2 ml minūtē.Veiciet sistēmas piemērotības šķīduma hromatogrāfiju un ierakstiet maksimālās atbildes reakcijas, kā norādīts procedūrā: izšķirtspēja R starp gemcitabīna anomēru un gemcitabīnu nav mazāka par 8,0;un pēc gemcitabīna noteiktais astes koeficients nav lielāks par 1,5.Hromatografējiet standarta preparātu un pierakstiet maksimālās atbildes reakcijas, kā norādīts procedūrā: relatīvā standarta novirze atkārtotām injekcijām nav lielāka par 1,0%.
Procedūra – Atsevišķi injicējiet vienādus tilpumus (apmēram 20 µL) standarta preparāta un testa preparāta hromatogrāfā, pierakstiet hromatogrammas un izmēra atbildes reakcijas uz galvenajiem pīķiem.Aprēķiniet C9H11F2N3O4·HCl daudzumu miligramos gemcitabīna hidrohlorīda daļā, ko ņem pēc formulas:
200 C (rU/rS)
kurā C ir USP Gemcitabine Hydrochloride RS koncentrācija, izteikta mg/ml, standarta preparātā;un rU un rS ir maksimālās atbildes reakcijas, kas iegūtas attiecīgi no testa preparāta un standarta preparāta.
-

Gemcitabīna hidrohlorīds CAS 122111-03-9 API U...
-

Gemcitabine CAS 95058-81-4 Tests 98,0–102,0%
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Doksorubicīna hidrohlorīds CAS 25316-40-9 API ASV...
-

Enalaprila maleāta CAS 76095-16-4 tests 98,0–102...
-

Guanfacīna hidrohlorīds Guanfacīna HCl CAS 291...
-

Irinotekāna hidrohlorīds CAS 100286-90-6 Tīrība...
-

Levetiracetāms LEV CAS 102767-28-2 API rūpnīcas U...
-

Naltreksona hidrohlorīds CAS 16676-29-2 API USP...
-

Noskapīna hidrohlorīda hidrāts CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0–100,5% USP B...
-

Darunavīra CAS 206361-99-1 Anti-HIV tīrība ≥99,0...
-

Ezetimibs CAS 163222-33-1 Tīrība 98,5% ~ 102,0% (...
-

Lasofoksifēna tartrāts CAS 190791-29-8 Chiral Pu...
-

Bortezomib CAS 179324-69-7 Tīrība ≥99,0% (HPLC)...
-

CAS 274901-16-5 Tīrība ≥99,0% (HPLC) API