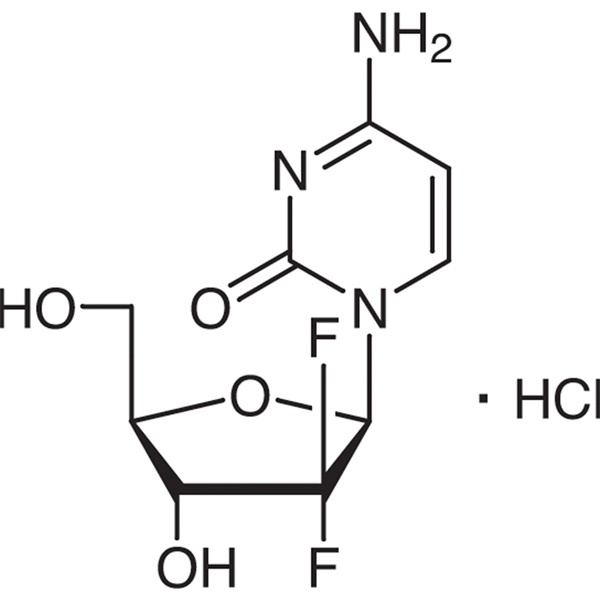
Chlorowodorek gemcytabiny CAS 122111-03-9 Standard API USP35
Ruifu Chemical jest wiodącym producentem chlorowodorku gemcytabiny (CAS: 122111-03-9) o wysokiej jakości produkcji komercyjnej.Ruifu Chemical może zapewnić dostawę na całym świecie, konkurencyjne ceny, doskonałą obsługę, dostępne małe i hurtowe ilości.Kup chlorowodorek gemcytabiny,Please contact: alvin@ruifuchem.com
| Nazwa chemiczna | chlorowodorek gemcytabiny |
| Synonimy | chlorowodorek gemcytabiny;chlorowodorek 2'-deoksy-2',2'-difluorocytydyny;dFdC;dFdCyd;Gemzar;LY188011 Chlorowodorek;Gemcitera;Gemsar |
| Numer CAS | 122111-03-9 |
| Powiązany CAS | 95058-81-4 - Bezpłatna baza |
| Stan magazynowy | Na stanie, zdolność produkcyjna 5 ton |
| Formuła molekularna | C9H12ClF2N3O4 |
| Waga molekularna | 299,66 |
| Temperatura topnienia | >250℃ |
| Warunki wysyłki | W temperaturze otoczenia |
| COA i MSDS | Dostępny |
| Pochodzenie | Szanghai Chiny |
| Marka | Firma chemiczna Ruifu |
| Przedmiot | Specyfikacje | Wyniki |
| Wygląd | Biały krystaliczny proszek, bezwonny | Spełnia wymagania |
| Rozpuszczalność | Rozpuszczalny w wodzie, słabo rozpuszczalny w metanolu, praktycznie nierozpuszczalny w acetonie | Spełnia wymagania |
| Identyfikator IR | Widmo IR powinno być zgodne z ten z wzorca referencyjnego | Spełnia wymagania |
| Identyfikacja Chlorek | Pozytywny.Spełnia wymagania testów na obecność chlorków | Spełnia wymagania |
| Pojawienie się rozwiązania | Roztwór S w sposób klarowny i niezbyt intensywny zabarwiony niż roztwór wzorcowy BY7 | Spełnia wymagania |
| pH | 2,0~3,0 | 2.6 |
| Skręcalność właściwa [α]20/D | +43,0° do +50,0° | +47,5° |
| Metale ciężkie (Pb) | ≤10ppm | <10 ppm |
| Strata przy suszeniu | ≤1,00% | 0,3% |
| Pozostałości po zapłonie | ≤0,10% | 0,03% |
| Substancje pokrewne | ||
| Cytozyna | ≤0,10% | 0,01% |
| α-Izomer | ≤0,10% | 0,01% |
| Wszelkie inne zanieczyszczenia | ≤0,10% | 0,04% |
| Całkowite zanieczyszczenia | ≤0,20% | 0,1% |
| Pozostałości rozpuszczalników | ||
| Metanol | ≤0,30% | Niewykryty |
| Toluen | ≤0,01% | Niewykryty |
| dichlorometan | ≤0,01% | Niewykryty |
| Aceton | ≤0,50% | 0,1% |
| Analiza | 97,5% ~ 101,5% (w przeliczeniu na suchą bazę) | 99,9% |
| Wniosek | Zgodny ze standardem USP35 | |
Pakiet:Butelka, worek z folii aluminiowej, 25 kg / bęben kartonowy lub zgodnie z wymaganiami klienta.
Warunki przechowywania:Przechowywać pojemnik szczelnie zamknięty i przechowywać w chłodnym, suchym i dobrze wentylowanym magazynie, z dala od niezgodnych substancji.Unikaj wystawiania na bezpośrednie działanie promieni słonecznych, wilgoci i nadmiernego ciepła.
Wysyłka:Dostarcz na cały świat drogą powietrzną, przez FedEx / DHL Express.Zapewnij szybką i niezawodną dostawę.


Kody Ryzyka R21 - Działa szkodliwie w kontakcie ze skórą
R36/38 – Działa drażniąco na oczy i skórę.
R46 – Może powodować dziedziczne wady genetyczne
R62 - Możliwe ryzyko upośledzenia płodności
R63 – Możliwe ryzyko szkody dla nienarodzonego dziecka
Opis bezpieczeństwa S25 – Unikać kontaktu z oczami.
S26 - Zanieczyszczone oczy przemyć natychmiast dużą ilością wody i zasięgnąć porady lekarza.
S36/37 - Nosić odpowiednią odzież ochronną i odpowiednie rękawice ochronne.
S53 - Unikać narażenia - przed użyciem zapoznać się z instrukcją.
WGK Niemcy 3
RTECS HA3840000
Kod HS 2942000000
Chlorowodorek gemcytabiny (CAS: 122111-03-9) to nowy syntetyczny lek difluoronukleozydowy, który ma działanie antymetaboliczne i przeciwnowotworowe.Jest badany i rozwijany przez Eli Lilly and Company i zatwierdzony do umieszczenia na liście w RPA, Szwecji, Holandii, Australii i innych krajach w 1995 roku. Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła go jako terapię pierwszego rzutu do klinicznego leczenia niedrobnokomórkowego raka płuc i raka trzustki.
W ostatnich latach nowe leki, takie jak gemcytabina, paklitaksel, docetaksel, winorebina, są skutecznymi lekami w leczeniu niedrobnokomórkowego raka płuca (w skrócie NSCLC).W porównaniu z tradycyjnymi lekami chemioterapeutycznymi, leki te mają zalety silnego działania leczniczego i niskiej toksyczności.Chlorowodorek gemcytabiny jest lekiem antymetabolitowym nowej generacji i rodzajem specjalnego leku na cykl komórkowy, odgrywającego główną rolę w fazie syntezy DNA, czyli fazie S komórek.W pewnych warunkach lek ten może zapobiegać progresji komórek z fazy G1 do fazy S i wykazuje silne działanie przeciwnowotworowe niedrobnokomórkowego raka płuca (NSCLC).Badania zagraniczne wykazały, że skuteczność pojedynczego leczenia NSCLC samym chlorowodorkiem gemcytabiny wynosi około 18% ~ 35%, podczas gdy w połączeniu z cisplatyną skuteczność leczenia NSCLC wynosi 41,7%.W zaawansowanym NSCLC skuteczna dawka karboplatyny wynosi 16%, co jest zbliżone do cisplatyny, ale ma niską toksyczność, zwłaszcza w przypadku reakcji żołądkowo-jelitowych, supresji szpiku kostnego oraz reakcji toksycznej nerek i zakończeń nerwowych.W połączeniu z karboplatyną oba mają wzajemną koordynację i działanie addytywne i mogą dawać większe efekty lecznicze.
chlorowodorek gemcytabiny
C9H11F2N3O4·HCl 299,66
Cytydyna, 2′-dezoksy-2′,2′-difluro-, monochlorowodorek.
Monochlorowodorek 2′-deoksy-2′,2′-difluorocytydyny (β-izomer) [122111-03-9].
» Chlorowodorek gemcytabiny zawiera nie mniej niż 97,5 procent i nie więcej niż 101,5 procent C9H11F2N3O4·HCl, obliczone w stanie obecnym.
[Uwaga – chlorowodorek gemcytabiny jest silnym środkiem cytotoksycznym.Należy zachować szczególną ostrożność, aby zapobiec wdychaniu cząstek i narażeniu na nie skóry.]
Pakowanie i przechowywanie - Przechowywać w szczelnych pojemnikach.
Etykietowanie – w przypadku gdy jest przeznaczony do przygotowywania postaci dawkowania do wstrzykiwania, etykieta stwierdza, że jest sterylna lub musi zostać poddana dalszemu przetwarzaniu podczas przygotowywania postaci dawkowania do wstrzykiwania.
Normy referencyjne USP <11>-
USP Cytozyna RS
USP Endotoksyna RS
USP chlorowodorek gemcytabiny RS
Identyfikacja-
O: Absorpcja w podczerwieni <197 K>.
B: Spełnia wymagania testów dla chlorków <191>.
Skręcalność właściwa <781S>: między +43 a +50, przy 20.
Roztwór testowy: 10 mg na ml.
pH <791>: między 2,0 a 3,0, w roztworze zawierającym 10 mg na ml.
Pozostałość po prażeniu <281>: nie więcej niż 0,1%.
Metale ciężkie, metoda I <231>: 0,001%.
Czystość chromatograficzna-
Roztwór A- Postępuj zgodnie z zaleceniami dotyczącymi fazy ruchomej w teście.
Roztwór B — Przygotuj przefiltrowany i odgazowany metanol.
Faza ruchoma - Użyj zmiennych mieszanin Roztworu A i Roztworu B zgodnie z zaleceniami w Systemie chromatograficznym.W razie potrzeby dokonaj regulacji (patrz Odpowiedniość systemu w części Chromatografia 621).
Rozwiązanie sprawdzające zgodność systemu — postępuj zgodnie z zaleceniami w teście.
Roztwór wzorcowy — rozpuścić dokładnie odważoną ilość USP Gemcitabine Hydrochloride RS i USP Cytosine RS w wodzie i rozcieńczyć ilościowo, w razie potrzeby stopniowo, aby uzyskać roztwór o znanym stężeniu około 2 µg na ml każdego z nich.
Roztwór testowy – przenieść około 50 mg dokładnie odważonego chlorowodorku gemcytabiny do kolby miarowej o pojemności 25 ml, rozpuścić i rozcieńczyć wodą do kreski i wymieszać.
System chromatograficzny (patrz Chromatografia 621) - Postępuj zgodnie z zaleceniami w części Test.Chromatograf jest programowany w następujący sposób.
Czas (minuty) Roztwór A (%) Roztwór B (%) Elucja
0–8 97 3 izokratyczny
8–13 97®50 3®50 gradient liniowy
13–20 50 50 izokratyczny
20–25 50®97 50®3 ponowne zrównoważenie
Chromatografować roztwór dopasowujący układ i rejestrować odpowiedzi szczytowe zgodnie z procedurą: względne czasy retencji wynoszą około 0,5 dla anomeru gemcytabiny i 1,0 dla gemcytabiny;rozdzielczość, R, pomiędzy anomerem gemcytabiny i gemcytabiną jest nie mniejsza niż 8,0;a współczynnik ogonowania dla gemcytabiny nie przekracza 1,5.Chromatografować roztwór wzorcowy i rejestrować odpowiedzi szczytowe zgodnie z procedurą: względne czasy retencji wynoszą około 0,1 dla cytozyny i 1,0 dla gemcytabiny;względne odchylenie standardowe dla powtarzanych wstrzyknięć nie przekracza 2,0%.
Procedura — Oddzielnie wstrzyknąć objętość (około 20 µl) roztworu wzorcowego i roztworu testowego do chromatografu, zapisać chromatogram i zmierzyć wszystkie odpowiedzi szczytowe.Oblicz procentową zawartość cytozyny w porcji gemcytabiny według wzoru:
2,5(Cc / W)(rt / rs)
gdzie Cc to stężenie USP Cytosine RS w roztworze wzorcowym, w µg na ml;W oznacza wagę w mg przyjętej gemcytabiny;rt oznacza odpowiedź szczytową dla cytozyny w roztworze testowym;a rs jest odpowiedzią na cytozynę w roztworze standardowym: znaleziono nie więcej niż 0,1% cytozyny.Oblicz zawartość procentową każdego zanieczyszczenia innego niż cytozyna w części gemcytabiny pobranej według wzoru:
2,5(Cs / W)(ri / rs)
gdzie Cs jest stężeniem USP Gemcitabine Hydrochloride RS w roztworze wzorcowym, w µg na ml;W oznacza wagę w mg przyjętej gemcytabiny;ri oznacza odpowiedź szczytową dla każdego zanieczyszczenia w roztworze testowym;a rs jest odpowiedzią na gemcytabinę w roztworze standardowym: nie więcej niż 0,1% anomeru gemcytabiny lub jakiekolwiek inne pojedyncze zanieczyszczenie;a suma wszystkich zanieczyszczeń nie przekracza 0,2%.Wykluczyć z sumy wszystkich zanieczyszczeń wszelkie piki, które są poniżej granicy oznaczenia ilościowego (0,02%).
Inne wymagania — Tam, gdzie na etykiecie podano, że chlorowodorek gemcytabiny jest sterylny, spełnia on wymagania dotyczące endotoksyn bakteryjnych i sterylności w ramach produktu Gemcitabine for Injection.Tam, gdzie na etykiecie podano, że chlorowodorek gemcytabiny musi zostać poddany dalszemu przetwarzaniu podczas przygotowywania postaci dawkowania do wstrzykiwań, spełnia on wymagania dotyczące endotoksyn bakteryjnych w ramach gemcytabiny do wstrzykiwań.
Analiza-
Faza ruchoma - Przygotuj przesączony i odgazowany roztwór zawierający 13,8 g jednozasadowego fosforanu sodu i 2,5 ml kwasu fosforowego w 1000 ml wody.[Uwaga – pH tego roztworu wynosi od 2,4 do 2,6.]
Roztwór sprawdzający zgodność systemu — Przenieś około 10 mg chlorowodorku gemcytabiny do małej fiolki, dodaj 4 ml roztworu zawierającego 168 mg wodorotlenku potasu na ml metanolu, szczelnie zakręć i poddaj działaniu ultradźwięków.Ogrzewać w temperaturze 55°C przez 6 do 16 godzin, pozostawić do ostygnięcia i przenieść zawartość do kolby miarowej o pojemności 100 ml, przemywając kolejno 1% (v/v) kwasem fosforowym.Rozcieńczyć 1% kwasem fosforowym do objętości i wymieszać.[uwaga — ten roztwór zawiera około 0,02 mg na ml α-anomeru gemcytabiny.]
Przygotowanie wzorcowe - Rozpuścić dokładnie odważoną ilość USP Gemcitabine Hydrochloride RS w wodzie i rozcieńczyć ilościowo, w razie potrzeby stopniowo, wodą, aby otrzymać roztwór o znanym stężeniu około 0,1 mg na ml.
Przygotowanie testu - Przenieść dokładnie odważone około 20 mg chlorowodorku gemcytabiny do kolby miarowej o pojemności 200 ml, rozpuścić i rozcieńczyć wodą do kreski i wymieszać.
System chromatograficzny (patrz Chromatografia <621>) – Chromatograf cieczowy jest wyposażony w detektor 275 nm i kolumnę 4,6 mm × 25 cm zawierającą wypełnienie 5 µm L7.Szybkość przepływu wynosi około 1,2 ml na minutę.Przeprowadzić chromatografię roztworu dopasowującego układ i zapisać odpowiedzi szczytowe zgodnie z procedurą: rozdzielczość, R, między anomerem gemcytabiny a gemcytabiną jest nie mniejsza niż 8,0;a współczynnik ogonowania określony dla gemcytabiny wynosi nie więcej niż 1,5.Poddać chromatografii preparat standardowy i zapisać odpowiedzi pików zgodnie z procedurą: względne odchylenie standardowe dla powtórzonych nastrzyków nie przekracza 1,0%.
Procedura — Oddzielnie wstrzyknąć równe objętości (około 20 µl) preparatu standardowego i preparatu testowego do chromatografu, zapisać chromatogramy i zmierzyć odpowiedzi dla głównych pików.Obliczyć w mg ilość C9H11F2N3O4·HCl w porcji chlorowodorku gemcytabiny, korzystając ze wzoru:
200C(rU / rS)
gdzie C oznacza stężenie, w mg na ml, USP Gemcitabine Hydrochloride RS w preparacie standardowym;a rU i rS są odpowiedziami szczytowymi uzyskanymi odpowiednio z preparatu testowego i preparatu standardowego.
-

Chlorowodorek gemcytabiny CAS 122111-03-9 API U...
-

Gemcytabina CAS 95058-81-4 Test 98,0 ~ 102,0%
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Chlorowodorek doksorubicyny CAS 25316-40-9 API US...
-

Maleinian enalaprylu CAS 76095-16-4 Test 98,0 ~ 102 ...
-

Chlorowodorek guanfacyny Guanfacyna HCl CAS 291...
-

Chlorowodorek irynotekanu CAS 100286-90-6 Czyst...
-

Lewetyracetam LEV CAS 102767-28-2 Fabryka API U...
-

Chlorowodorek naltreksonu CAS 16676-29-2 API USP...
-

Wodzian chlorowodorku noskapiny CAS 912-60-7 AP...
-

Lewodopa (L-DOPA) CAS 59-92-7 99,0 ~ 100,5% USP B...
-

Darunavir CAS 206361-99-1 Czystość anty-HIV ≥99,0 ...
-

Ezetymib CAS 163222-33-1 Czystość 98,5% ~ 102,0% (...
-

Winian lasofoksyfenu CAS 190791-29-8 Chiralny...
-

Bortezomib CAS 179324-69-7 Czystość ≥99,0% (HPLC)...
-

CAS 274901-16-5 Czystość ≥99,0% (HPLC) API