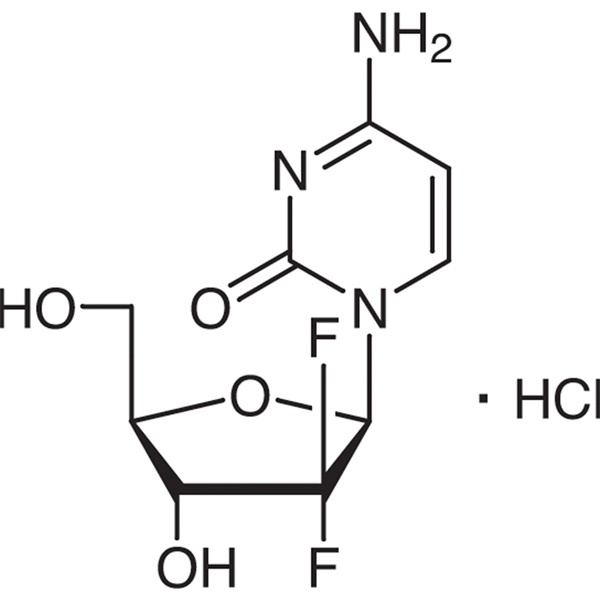
Cloridrato de Gemcitabina CAS 122111-03-9 API USP35 Padrão
Ruifu Chemical é o principal fabricante de cloridrato de gemcitabina (CAS: 122111-03-9) com produção comercial de alta qualidade.Ruifu Chemical pode fornecer entrega em todo o mundo, preço competitivo, excelente serviço, pequenas e grandes quantidades disponíveis.Comprar Cloridrato de Gencitabina,Please contact: alvin@ruifuchem.com
| Nome químico | Cloridrato de Gencitabina |
| sinônimos | Gemcitabina HCl;Cloridrato de 2'-Desoxi-2',2'-Difluorocitidina;dFdC;dFdCyd;Gemzar;LY188011 Cloridrato;Gemcitera;gemsar |
| Número CAS | 122111-03-9 |
| CAS relacionado | 95058-81-4 - Base Gratuita |
| Status do Estoque | Em Estoque, Capacidade de Produção 5 Toneladas |
| Fórmula molecular | C9H12ClF2N3O4 |
| Peso molecular | 299,66 |
| Ponto de fusão | >250℃ |
| Condição de envio | Abaixo da temperatura ambiente |
| COA e FISPQ | Disponível |
| Origem | Xangai, China |
| Marca | Ruifu Químico |
| Item | Especificações | Resultados |
| Aparência | Pó cristalino branco, inodoro | cumpre |
| Solubilidade | Solúvel em água, ligeiramente solúvel em metanol, praticamente insolúvel em acetona | cumpre |
| IR de identificação | O espectro IR deve ser concordante com o do padrão de referência | cumpre |
| Cloreto de Identificação | Positivo.Atende aos requisitos dos testes para cloreto | cumpre |
| Aparência da Solução | Solução S em claro e não mais intensamente colorido que a solução de referência BY7 | cumpre |
| pH | 2,0~3,0 | 2.6 |
| Rotação Específica [α]20/D | +43,0° a +50,0° | +47,5° |
| Metais Pesados (Pb) | ≤10ppm | <10 ppm |
| Perda ao secar | ≤1,00% | 0,3% |
| Resíduo na Ignição | ≤0,10% | 0,03% |
| Substâncias relacionadas | ||
| Citosina | ≤0,10% | 0,01% |
| α-isômero | ≤0,10% | 0,01% |
| Qualquer outra impureza | ≤0,10% | 0,04% |
| Total de impurezas | ≤0,20% | 0,1% |
| Solventes residuais | ||
| Metanol | ≤0,30% | Não detectado |
| Tolueno | ≤0,01% | Não detectado |
| Diclorometano | ≤0,01% | Não detectado |
| Acetona | ≤0,50% | 0,1% |
| Ensaio | 97,5% ~ 101,5% (calculado em base seca) | 99,9% |
| Conclusão | Em conformidade com o padrão USP35 | |
Pacote:Garrafa, saco de folha de alumínio, tambor de 25kg/cartão, ou de acordo com a exigência do cliente.
Condição de armazenamento:Manter o recipiente bem fechado e armazenar em local fresco, seco e bem ventilado, longe de substâncias incompatíveis.Evite a exposição à luz solar direta, umidade e calor excessivo.
Envio:Entregue para todo o mundo por via aérea, por FedEx / DHL Express.Fornecer entrega rápida e confiável.


Códigos de risco R21 - Nocivo em contato com a pele
R36/38 - Irritante para os olhos e pele.
R46 - Pode causar danos genéticos hereditários
R62 - Possível risco de fertilidade prejudicada
R63 - Possível risco de dano ao nascituro
Descrição de segurança S25 - Evite contato com os olhos.
S26 - Em caso de contato com os olhos, lavar imediatamente com água em abundância e consultar um médico.
S36/37 - Use roupas de proteção e luvas adequadas.
S53 - Evite a exposição - obtenha instruções especiais antes de usar.
WGK Alemanha 3
RTECS HA3840000
Código HS 2942000000
O cloridrato de gemcitabina (CAS: 122111-03-9) é um novo medicamento sintético difluoronucleosídeo que é antimetabólico e antineoplásico.É pesquisado e desenvolvido pela Eli Lilly and Company e aprovado para ser listado na África do Sul, Suécia, Holanda, Austrália e outros países em 1995. A Administração de Alimentos e Medicamentos dos Estados Unidos (FDA) aprovou-o como terapia de primeira linha para o tratamento clínico de câncer de pulmão de células não pequenas e câncer de pâncreas.
Nos últimos anos, novos medicamentos como Gemcitabina, Paclitaxel, Docetaxel, Vinorebine são medicamentos eficazes para o tratamento de câncer de pulmão de células não pequenas (abreviado como NSCLC).Em comparação com as drogas quimioterápicas tradicionais, essas drogas têm as vantagens de alto efeito curativo e baixa toxicidade.O cloridrato de gencitabina é uma nova geração de medicamentos antimetabólitos e um tipo de medicamento especial para o ciclo celular, desempenhando um papel importante na fase de síntese do DNA, ou seja, na fase S das células.Sob certas condições, este medicamento pode impedir a progressão das células da fase G1 para a fase S e tem uma forte atividade anticâncer câncer de pulmão de células não pequenas (NSCLC).Estudos estrangeiros mostraram que a eficiência do tratamento único para NSCLC apenas com cloridrato de gencitabina é de cerca de 18% a 35%, enquanto a eficácia do tratamento combinado com cisplatina para NSCLC é de 41,7%.No NSCLC avançado, a taxa efetiva de carboplatina é de 16%, que é semelhante à cisplatina, mas tem baixa toxicidade, especialmente para reações gastrointestinais, supressão da medula óssea e reação tóxica do rim e das terminações nervosas.Em combinação com a carboplatina, ambos têm coordenação mútua e efeito aditivo, podendo produzir efeitos curativos superiores.
Cloridrato de Gencitabina
C9H11F2N3O4·HCl 299,66
Citidina, 2'-desoxi-2',2'-difluro-, monocloridrato.
Monocloridrato de 2'-desoxi-2',2'-difluorocitidina (isômero β) [122111-03-9].
» O cloridrato de gencitabina contém não menos que 97,5 por cento e não mais que 101,5 por cento de C9H11F2N3O4·HCl, calculado com base no estado em que se encontra.
[Cuidado: o cloridrato de gemcitabina é um potente agente citotóxico.Deve-se tomar muito cuidado para evitar a inalação de partículas e expor a pele a elas.]
Embalagem e armazenamento-Preservar em recipientes apertados.
Rotulagem - Onde for destinado ao uso na preparação de formas farmacêuticas injetáveis, o rótulo indica que é estéril ou deve ser submetido a processamento adicional durante a preparação de formas farmacêuticas injetáveis.
Padrões de referência da USP <11>-
USP Citosina RS
USP Endotoxina RS
Cloridrato de Gemcitabina USP RS
Identificação-
A: Absorção de infravermelho <197K>.
B: Atende aos requisitos dos testes para Cloreto <191>.
Rotação específica <781S>: entre +43 e +50, a 20.
Solução de teste: 10 mg por mL.
pH <791>: entre 2,0 e 3,0, em solução contendo 10 mg por mL.
Resíduo na ignição <281>: não mais que 0,1%.
Metais pesados, Método I <231>: 0,001%.
Pureza cromatográfica-
Solução A- Proceda conforme indicado para a fase Móvel no Ensaio.
Solução B-Preparar metanol filtrado e desgaseificado.
Fase móvel - Use misturas variáveis de Solução A e Solução B conforme indicado no sistema cromatográfico.Faça ajustes, se necessário (consulte Adequação do sistema em Cromatografia 621).
Solução de adequação do sistema - Proceda conforme indicado no Ensaio.
Solução padrão - Dissolva uma quantidade pesada com precisão de USP Gemcitabine Hydrochloride RS e USP Cytosine RS em água e dilua quantitativamente e gradualmente, se necessário, para obter uma solução com uma concentração conhecida de cerca de 2 µg por mL de cada.
Solução de teste - Transferir cerca de 50 mg de Cloridrato de Gemcitabina, pesado com precisão, para um balão volumétrico de 25 mL, dissolver e diluir com água até o volume e misturar.
Sistema cromatográfico (consulte Cromatografia 621) - Proceda conforme indicado em Ensaio.O cromatógrafo é programado da seguinte forma.
Tempo (minutos) Solução A (%) Solução B (%) Eluição
0–8 97 3 isocrático
8–13 97®50 3®50 gradiente linear
13–20 50 50 isocrático
20–25 50®97 50®3 reequilíbrio
Faça a cromatografia da solução de adequação do Sistema e registre as respostas de pico conforme indicado no Procedimento: os tempos de retenção relativos são cerca de 0,5 para gencitabina -anômero e 1,0 para gencitabina;a resolução, R, entre gemcitabina -anômero e gemcitabina não é inferior a 8,0;e o fator de cauda para gencitabina não é superior a 1,5.Faça a cromatografia da solução Padrão e registre as respostas de pico conforme indicado no Procedimento: os tempos de retenção relativos são cerca de 0,1 para citosina e 1,0 para gencitabina;o desvio padrão relativo para injeções replicadas não é superior a 2,0%.
Procedimento-Injete separadamente um volume (cerca de 20 µL) da solução padrão e da solução de teste no cromatógrafo, registre o cromatograma e meça todas as respostas de pico.Calcule a porcentagem de citosina na porção de Gemcitabina tomada pela fórmula:
2.5(Cc/W)(rt/rs)
em que Cc é a concentração de USP Cytosine RS na solução padrão, em µg por mL;W é o peso, em mg, de Gemcitabina tomada;rt é a resposta de pico para citosina na solução de teste;e rs é a resposta para a citosina na solução Padrão: não é encontrado mais de 0,1% de citosina.Calcule a porcentagem de cada impureza diferente da citosina na porção de Gemcitabina tomada pela fórmula:
2.5(Cs/W)(ri/rs)
em que Cs é a concentração de Cloridrato de Gemcitabina USP RS na solução Padrão, em µg por mL;W é o peso, em mg, de Gemcitabina tomada;ri é a resposta de pico para cada impureza na solução de teste;e rs é a resposta devida à gencitabina na solução Padrão: não é encontrado mais de 0,1% de gencitabina -anômero ou qualquer outra impureza individual;e a soma de todas as impurezas não é superior a 0,2%.Exclua da soma de todas as impurezas quaisquer picos que estejam abaixo do limite de quantificação (0,02%).
Outros requisitos - Onde o rótulo declara que o cloridrato de gencitabina é estéril, ele atende aos requisitos para endotoxinas bacterianas e esterilidade em gencitabina para injeção.Onde o rótulo declara que o Cloridrato de Gemcitabina deve ser submetido a processamento adicional durante a preparação de formas farmacêuticas injetáveis, ele atende aos requisitos para Endotoxinas bacterianas em Gemcitabina para Injeção.
Ensaio-
Fase móvel-Prepare uma solução filtrada e desgaseificada contendo 13,8 g de fosfato de sódio monobásico e 2,5 mL de ácido fosfórico em 1000 mL de água.[nota-O pH desta solução está entre 2,4 e 2,6.]
Solução de adequação do sistema - Transfira cerca de 10 mg de Cloridrato de Gemcitabina para um pequeno frasco, adicione 4 mL de uma solução contendo 168 mg de hidróxido de potássio por mL de metanol, tampe bem e aplique sonicação.Aquecer a 55º por 6 a 16 horas, deixar esfriar e transferir o conteúdo para balão volumétrico de 100 mL com lavagens sucessivas com ácido fosfórico 1% (v/v).Diluir com ácido fosfórico a 1% até o volume e misturar.[nota: esta solução contém cerca de 0,02 mg por mL de α-anômero de gencitabina.]
Preparação padrão - Dissolva uma quantidade precisamente pesada de USP Gemcitabine Hydrochloride RS em água e dilua quantitativamente e gradualmente, se necessário, com água para obter uma solução com uma concentração conhecida de cerca de 0,1 mg por mL.
Preparação do ensaio - Transfira cerca de 20 mg de Cloridrato de Gemcitabina, pesado com precisão, para um balão volumétrico de 200 mL, dissolva e dilua com água até o volume e misture.
Sistema cromatográfico (consulte Cromatografia <621>) - O cromatógrafo líquido é equipado com um detector de 275 nm e uma coluna de 4,6 mm × 25 cm que contém L7 de empacotamento de 5 µm.A taxa de fluxo é de cerca de 1,2 mL por minuto.Faça a cromatografia da solução de adequação do Sistema e registre as respostas de pico conforme indicado no Procedimento: a resolução, R, entre o anômero de gencitabina e a gencitabina não é inferior a 8,0;e o fator de cauda determinado a partir da gencitabina não é superior a 1,5.Faça a cromatografia da preparação padrão e registre as respostas de pico conforme indicado no Procedimento: o desvio padrão relativo para injeções replicadas não é superior a 1,0%.
Procedimento-Injete separadamente volumes iguais (cerca de 20 µl) da preparação padrão e da preparação de ensaio no cromatógrafo, registre os cromatogramas e meça as respostas para os picos principais.Calcule a quantidade, em mg, de C9H11F2N3O4·HCl na porção de Cloridrato de Gemcitabina tomada pela fórmula:
200C(rU / rS)
em que C é a concentração, em mg por mL, de USP Gemcitabine Hydrochloride RS na preparação padrão;e rU e rS são as respostas de pico obtidas a partir da preparação do ensaio e da preparação padrão, respectivamente.
-

Cloridrato de Gemcitabina CAS 122111-03-9 API U...
-

Ensaio de gencitabina CAS 95058-81-4 98,0~102,0%
-

Cloridrato de Cefotiam CAS 66309-69-1 API USP S...
-

Cloridrato de Doxorrubicina CAS 25316-40-9 API US...
-

Maleato de Enalapril CAS 76095-16-4 Ensaio 98,0~102...
-

Cloridrato de Guanfacina Guanfacina HCl CAS 291...
-

Cloridrato de Irinotecano CAS 100286-90-6 Pureza...
-

Levetiracetam LEV CAS 102767-28-2 API Factory U...
-

Cloridrato de Naltrexona CAS 16676-29-2 API USP...
-

Hidrato de cloridrato de noscapina CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Darunavir CAS 206361-99-1 Pureza anti-HIV ≥99,0...
-

Ezetimiba CAS 163222-33-1 Pureza 98,5%~102,0% (...
-

Lasofoxifene Tartrate CAS 190791-29-8 Chiral Pu...
-

Bortezomibe CAS 179324-69-7 Pureza ≥99,0% (HPLC)...
-

CAS 274901-16-5 Pureza ≥99,0% (HPLC) API