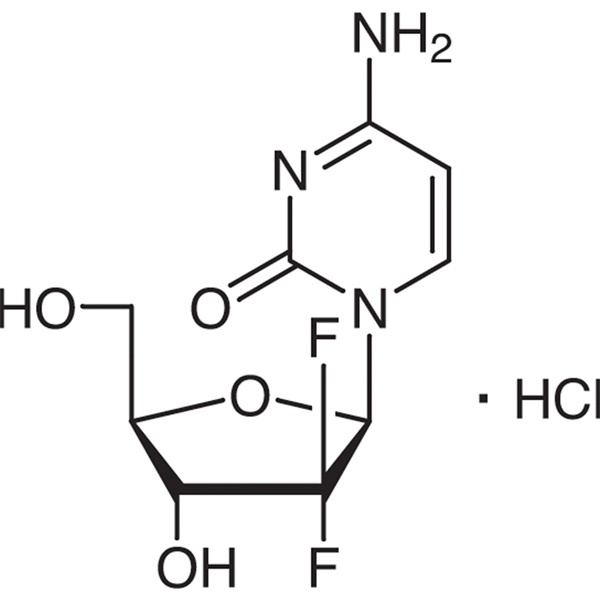
Гемцитабин гидрохлорид CAS 122111-03-9 Стандарт API USP35
Ruifu Chemical является ведущим производителем гидрохлорида гемцитабина (CAS: 122111-03-9) с высококачественным коммерческим производством.Ruifu Chemical может обеспечить доставку по всему миру, конкурентоспособные цены, отличный сервис, небольшие и оптовые количества.Купить гемцитабина гидрохлорид,Please contact: alvin@ruifuchem.com
| Химическое название | гемцитабина гидрохлорид |
| Синонимы | гемцитабина гидрохлорид;гидрохлорид 2'-дезокси-2',2'-дифторцитидина;дФдК;дФдСид;Гемзар;LY188011 гидрохлорид;Гемситера;Гемсар |
| Количество CAS | 122111-03-9 |
| Связанный CAS | 95058-81-4 - Бесплатная база |
| Статус запаса | В наличии, производственная мощность 5 тонн |
| Молекулярная формула | C9H12ClF2N3O4 |
| Молекулярная масса | 299,66 |
| Температура плавления | >250℃ |
| Состояние доставки | При температуре окружающей среды |
| сертификат подлинности и паспорт безопасности | Доступный |
| Источник | Шанхай, Китай |
| Бренд | Руифу Кемикал |
| Элемент | Технические характеристики | Полученные результаты |
| Появление | Белый кристаллический порошок без запаха | Соответствует |
| Растворимость | Растворим в воде, слабо растворим в метаноле, практически нерастворим в ацетоне | Соответствует |
| Идентификация ИК | ИК-спектр должен соответствовать эталонного стандарта | Соответствует |
| Идентификация хлорида | Положительный.Соответствует требованиям испытаний на хлорид | Соответствует |
| Внешний вид раствора | Раствор S в чистоте и не более интенсивно окрашенный, чем эталонный раствор BY7 | Соответствует |
| pH | 2,0~3,0 | 2,6 |
| Удельное вращение [α]20/D | от +43,0° до +50,0° | +47,5° |
| Тяжелые металлы (Pb) | ≤10 частей на миллион | <10 частей на миллион |
| Убыток от высыхания | ≤1,00% | 0,3% |
| Остаток при прокаливании | ≤0,10% | 0,03% |
| Связанные вещества | ||
| Цитозин | ≤0,10% | 0,01% |
| α-изомер | ≤0,10% | 0,01% |
| Любая другая примесь | ≤0,10% | 0,04% |
| Всего примесей | ≤0,20% | 0,1% |
| Остаточные растворители | ||
| Метанол | ≤0,30% | Не обнаружен |
| Толуол | ≤0,01% | Не обнаружен |
| Дихлорметан | ≤0,01% | Не обнаружен |
| Ацетон | ≤0,50% | 0,1% |
| анализ | 97,5%~101,5% (рассчитано на высушенную основу) | 99,9% |
| Заключение | Соответствует стандарту USP35 | |
Упаковка:Бутылка, мешок из алюминиевой фольги, 25 кг/картонный барабан или по требованию заказчика.
Условия хранения:Держите контейнер плотно закрытым и храните в прохладном, сухом и хорошо проветриваемом помещении вдали от несовместимых веществ.Избегайте воздействия прямых солнечных лучей, влаги и чрезмерного нагрева.
Перевозки:Доставка по всему миру по воздуху, FedEx / DHL Express.Обеспечить быструю и надежную доставку.


Коды риска R21 – вреден при контакте с кожей
R36/38 - Раздражает глаза и кожу.
R46 - Может вызывать наследственные генетические повреждения
R62 - Возможный риск нарушения фертильности
R63 - Возможный риск причинения вреда нерожденному ребенку
Описание безопасности S25 - Избегайте попадания в глаза.
S26 - При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу.
S36/37 - Носите подходящую защитную одежду и перчатки.
S53 - Избегайте воздействия - перед использованием получите специальные инструкции.
ВГК Германия 3
РТЕКС HA3840000
Код ТН ВЭД 2942000000
Гемцитабина гидрохлорид (CAS: 122111-03-9) представляет собой новый синтетический дифторнуклеозидный препарат, обладающий антиметаболическим и противоопухолевым действием.Он исследован и разработан компанией Eli Lilly and Company и в 1995 году одобрен для включения в список в Южной Африке, Швеции, Нидерландах, Австралии и других странах. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило его в качестве терапии первой линии. для клинического лечения немелкоклеточного рака легкого и рака поджелудочной железы.
В последние годы новые препараты, такие как гемцитабин, паклитаксел, доцетаксел, виноребин, являются эффективными препаратами для лечения немелкоклеточного рака легкого (сокращенно НМРЛ).По сравнению с традиционными химиотерапевтическими препаратами эти препараты обладают преимуществами высокого лечебного эффекта и низкой токсичности.Гемцитабина гидрохлорид представляет собой антиметаболитный препарат нового поколения и тип специального лекарственного средства для клеточного цикла, играющего важную роль в фазе синтеза ДНК, а именно в S-фазе клеток.При определенных условиях это лекарство может предотвратить переход клеток из фазы G1 в фазу S и обладает сильной противораковой активностью при немелкоклеточном раке легкого (НМРЛ).Зарубежные исследования показали, что эффективность однократного лечения НМРЛ только гемцитабина гидрохлоридом составляет около 18-35%, тогда как при сочетании лечения с цисплатином эффективность НМРЛ составляет 41,7%.При распространенном НМРЛ эффективная доза карбоплатина составляет 16%, что аналогично цисплатину, но обладает низкой токсичностью, особенно при желудочно-кишечных реакциях, угнетении костного мозга и токсической реакции почек и нервных окончаний.В сочетании с карбоплатином оба они обладают взаимной координацией и аддитивным эффектом и могут давать более высокие лечебные эффекты.
гемцитабина гидрохлорид
C9H11F2N3O4·HCl 299,66
Цитидин, 2'-дезокси-2',2'-дифтор-, моногидрохлорид.
2'-дезокси-2',2'-дифторцитидина моногидрохлорид (β-изомер) [122111-03-9].
» Гемцитабина гидрохлорид содержит не менее 97,5% и не более 101,5% C9H11F2N3O4·HCl в пересчете на фактическую основу.
[Предупреждение-Гемцитабин гидрохлорид является мощным цитотоксическим агентом.Следует проявлять большую осторожность, чтобы предотвратить вдыхание частиц и их воздействие на кожу.]
Упаковка и хранение - Консервировать в герметичной таре.
Маркировка. Если препарат предназначен для использования при приготовлении инъекционных лекарственных форм, на этикетке указывается, что он стерилен или должен быть подвергнут дальнейшей обработке при приготовлении инъекционных лекарственных форм.
Справочные стандарты USP <11>-
USP Цитозин RS
USP Эндотоксин RS
USP гемцитабина гидрохлорид RS
Идентификация-
A: Инфракрасное поглощение <197K>.
B: Соответствует требованиям испытаний на содержание хлорида <191>.
Удельное вращение <781S>: от +43 до +50, при 20.
Тестовый раствор: 10 мг на мл.
pH <791>: от 2,0 до 3,0 в растворе, содержащем 10 мг на мл.
Остаток при прокаливании <281>: не более 0,1%.
Тяжелые металлы, метод I <231>: 0,001%.
Хроматографическая чистота-
Решение А. Действуйте, как указано для подвижной фазы в анализе.
Решение B-Подготовьте отфильтрованный и дегазированный метанол.
Подвижная фаза. Используйте переменные смеси раствора А и раствора В, как указано в хроматографической системе.При необходимости внесите коррективы (см. «Пригодность системы» в разделе «Хроматография 621»).
Решение о пригодности системы — действуйте, как указано в анализе.
Стандартный раствор. Растворите точно взвешенное количество USP гемцитабина гидрохлорида RS и USP цитозина RS в воде и разбавьте количественно и, при необходимости, поэтапно, чтобы получить раствор с известной концентрацией около 2 мкг на мл каждого из них.
Тестовый раствор. Перенесите точно взвешенное около 50 мг гемцитабина гидрохлорида в мерную колбу на 25 мл, растворите и доведите до нужного объема водой и перемешайте.
Хроматографическая система (см. Хроматографию 621) – действуйте, как указано в разделе «Анализ».Хроматограф запрограммирован следующим образом.
Время (минуты) Раствор A (%) Раствор B (%) Элюирование
0–8 97 3 изократический
8–13 97®50 3®50 линейный градиент
13–20 50 50 изократический
20–25 50®97 50®3 повторное уравновешивание
Хроматографируйте раствор пригодности системы и запишите пиковые отклики, как указано в процедуре: относительное время удерживания составляет примерно 0,5 для гемцитабин-аномера и 1,0 для гемцитабина;разрешение R между гемцитабин-аномером и гемцитабином составляет не менее 8,0;а хвостовой коэффициент для гемцитабина не превышает 1,5.Хроматографируйте стандартный раствор и запишите пиковые ответы, как указано в процедуре: относительное время удерживания составляет примерно 0,1 для цитозина и 1,0 для гемцитабина;относительное стандартное отклонение для повторных инъекций не более 2,0%.
Процедура. Отдельно введите объем (около 20 мкл) стандартного раствора и тестового раствора в хроматограф, запишите хроматограмму и измерьте все отклики пиков.Рассчитайте процентное содержание цитозина в взятой порции гемцитабина по формуле:
2,5 (Кб/Вт) (к/к)
где Cc – концентрация USP Cytosine RS в стандартном растворе, мкг/мл;W представляет собой массу принятого гемцитабина в мг;rt представляет собой пик ответа на цитозин в тестовом растворе;rs – реакция на цитозин в растворе Стандарта: обнаружено не более 0,1% цитозина.Рассчитайте процент каждой примеси, кроме цитозина, в порции гемцитабина, взятой по формуле:
2,5 (Cs/W)(ri/rs)
где Cs — концентрация RS гемцитабина гидрохлорида USP в стандартном растворе, мкг на мл;W представляет собой массу принятого гемцитабина в мг;ri — пиковый отклик для каждой примеси в тестовом растворе;rs – отклик на гемцитабин в Стандартном растворе: обнаружено не более 0,1% гемцитабина-аномера или любой другой индивидуальной примеси;а сумма всех примесей не более 0,2%.Исключите из суммы всех примесей любые пики, которые находятся ниже предела количественного определения (0,02%).
Другие требования. Если на этикетке указано, что гемцитабина гидрохлорид стерилен, он соответствует требованиям к бактериальным эндотоксинам и стерильности в разделе «Гемцитабин для инъекций».Если на этикетке указано, что гемцитабина гидрохлорид должен быть подвергнут дальнейшей обработке во время приготовления инъекционных лекарственных форм, он соответствует требованиям к бактериальным эндотоксинам в разделе «Гемцитабин для инъекций».
анализ-
Подвижная фаза. Приготовьте отфильтрованный и дегазированный раствор, содержащий 13,8 г одноосновного фосфата натрия и 2,5 мл фосфорной кислоты в 1000 мл воды.[Примечание: pH этого раствора находится в диапазоне от 2,4 до 2,6.]
Раствор для пригодности системы. Перенесите около 10 мг гидрохлорида гемцитабина в небольшой флакон, добавьте 4 мл раствора, содержащего 168 мг гидроксида калия на мл метанола, плотно закройте крышкой и обработайте ультразвуком.Нагревают при 55°С в течение 6-16 часов, дают остыть и переносят содержимое в мерную колбу вместимостью 100 мл с последовательными промываниями 1% (об./об.) фосфорной кислотой.Разбавьте 1% фосфорной кислотой до объема и перемешайте.[примечание: этот раствор содержит около 0,02 мг гемцитабина α-аномера на мл.]
Стандартный препарат. Растворите точно взвешенное количество USP гемцитабина гидрохлорида RS в воде и разбавьте водой количественно и, при необходимости, поэтапно, чтобы получить раствор с известной концентрацией около 0,1 мг на мл.
Подготовка анализа. Перенесите примерно 20 мг гемцитабина гидрохлорида, точно взвешенных, в мерную колбу на 200 мл, растворите и разбавьте водой до нужного объема и перемешайте.
Хроматографическая система (см. Хроматография <621>). Жидкостный хроматограф оснащен детектором с длиной волны 275 нм и колонкой размером 4,6 мм × 25 см, содержащей насадку L7 размером 5 мкм.Скорость потока составляет около 1,2 мл в минуту.Хроматографируйте раствор для проверки пригодности системы и запишите отклики пиков, как указано в процедуре: разрешение R между гемцитабин-аномером и гемцитабином составляет не менее 8,0;и фактор хвоста, определенный для гемцитабина, не превышает 1,5.Хроматографируйте стандартный препарат и запишите пиковые отклики, как указано в процедуре: относительное стандартное отклонение для повторных инъекций не превышает 1,0%.
Процедура. Отдельно введите равные объемы (около 20 мкл) стандартного препарата и препарата для анализа в хроматограф, запишите хроматограммы и измерьте ответы для основных пиков.Рассчитайте количество, мг, C9H11F2N3O4·HCl в порции гемцитабина гидрохлорида, взятой по формуле:
200С(рУ/рС)
где C представляет собой концентрацию в мг на мл USP гемцитабина гидрохлорида RS в стандартном препарате;и rU и rS представляют собой пиковые ответы, полученные для препарата для анализа и стандартного препарата, соответственно.
-

Гемцитабин гидрохлорид CAS 122111-03-9 API U...
-

Анализ гемцитабина CAS 95058-81-4 98,0 ~ 102,0%
-

Цефотиам гидрохлорид CAS 66309-69-1 API USP S...
-

Доксорубицин гидрохлорид CAS 25316-40-9 API США...
-

Эналаприл малеат CAS 76095-16-4 Анализ 98.0~102...
-

Гуанфацин гидрохлорид Гуанфацин HCl CAS 291...
-

Иринотекан гидрохлорид CAS 100286-90-6 Чистота...
-

Леветирацетам LEV CAS 102767-28-2 Завод API U...
-

Налтрексона гидрохлорид CAS 16676-29-2 API USP...
-

Гидрат гидрохлорида носкапина CAS 912-60-7 AP...
-

Леводопа (L-ДОФА) CAS 59-92-7 99,0~100,5% USP B...
-

Дарунавир CAS 206361-99-1 Anti-HIV Purity ≥99.0...
-

Эзетимиб CAS 163222-33-1 Чистота 98,5% ~ 102,0% (...
-

Тартрат лазофоксифена CAS 190791-29-8 Хиральная п...
-

Бортезомиб CAS 179324-69-7 Чистота ≥99,0% (ВЭЖХ)...
-

CAS 274901-16-5 Чистота ≥99,0% (ВЭЖХ) API