Gemcitabine Hydrochloride CAS 122111-03-9 API USP35 มาตรฐาน
Ruifu Chemical เป็นผู้ผลิตชั้นนำของ Gemcitabine Hydrochloride (CAS: 122111-03-9) คุณภาพสูงที่ผลิตในเชิงพาณิชย์Ruifu Chemical สามารถให้บริการจัดส่งทั่วโลก ราคาที่แข่งขันได้ บริการที่เป็นเลิศ มีปริมาณน้อยและจำนวนมากซื้อ Gemcitabine ไฮโดรคลอไรด์Please contact: alvin@ruifuchem.com
| ชื่อสารเคมี | เจมซิตาบีน ไฮโดรคลอไรด์ |
| คำพ้องความหมาย | เจมซิตาบีน HCl;2'-ดีออกซี-2',2'-ไดฟลูออโรไซทิดีน ไฮโดรคลอไรด์;dFdC;dFdCyd;เจมซาร์ ;LY188011 ไฮโดรคลอไรด์;เจมซิเทรา;เจมซาร์ |
| หมายเลข CAS | 122111-03-9 |
| CAS ที่เกี่ยวข้อง | 95058-81-4 - ฐานฟรี |
| สถานะสต็อก | ในสต็อก กำลังการผลิต 5 ตัน |
| สูตรโมเลกุล | C9H12ClF2N3O4 |
| น้ำหนักโมเลกุล | 299.66 |
| จุดหลอมเหลว | > 250 ℃ |
| เงื่อนไขการจัดส่ง | ภายใต้อุณหภูมิแวดล้อม |
| COA และ MSDS | มีอยู่ |
| ต้นทาง | เซียงไฮ้ประเทศจีน |
| ยี่ห้อ | รุอิฟุ เคมีคอล |
| รายการ | ข้อมูลจำเพาะ | ผลลัพธ์ |
| รูปร่าง | ผงผลึกสีขาว ไม่มีกลิ่น | สอดคล้อง |
| ความสามารถในการละลาย | ละลายได้ในน้ำ ละลายได้เล็กน้อยในเมทานอล ไม่ละลายในอะซิโตน | สอดคล้อง |
| IR ประจำตัว | สเปกตรัม IR ควรสอดคล้องกับ ของมาตรฐานอ้างอิง | สอดคล้อง |
| การระบุคลอไรด์ | เชิงบวก.เป็นไปตามข้อกำหนดของการทดสอบคลอไรด์ | สอดคล้อง |
| ลักษณะที่ปรากฏของโซลูชัน | Solution S อย่างชัดเจนและไม่เข้มข้นขึ้น มีสีมากกว่าโซลูชันอ้างอิง BY7 | สอดคล้อง |
| pH | 2.0~3.0 | 2.6 |
| การหมุนเฉพาะ [α]20/D | +43.0° ถึง +50.0° | +47.5° |
| โลหะหนัก (Pb) | ≤10ppm | <10ppm |
| การสูญเสียจากการทำให้แห้ง | ≤1.00% | 0.3% |
| สารตกค้างในการจุดระเบิด | ≤0.10% | 0.03% |
| สารที่เกี่ยวข้อง | ||
| ไซโตซีน | ≤0.10% | 0.01% |
| α-ไอโซเมอร์ | ≤0.10% | 0.01% |
| สิ่งเจือปนอื่น ๆ | ≤0.10% | 0.04% |
| สิ่งสกปรกทั้งหมด | ≤0.20% | 0.1% |
| ตัวทำละลายตกค้าง | ||
| เมทานอล | ≤0.30% | ตรวจไม่พบ |
| โทลูอีน | ≤0.01% | ตรวจไม่พบ |
| ไดคลอโรมีเทน | ≤0.01% | ตรวจไม่พบ |
| อะซิโตน | ≤0.50% | 0.1% |
| การทดสอบ | 97.5%~101.5% (คำนวณจากฐานแห้ง) | 99.9% |
| บทสรุป | เป็นไปตามมาตรฐาน USP35 | |
บรรจุุภัณฑ์:ขวด, ถุงอลูมิเนียมฟอยล์, 25 กก. / กระดาษแข็งกลองหรือตามความต้องการของลูกค้า
สภาพการเก็บรักษา:ปิดภาชนะให้สนิทและเก็บในคลังสินค้าที่เย็น แห้ง และมีอากาศถ่ายเทสะดวก ห่างจากสารที่เข้ากันไม่ได้หลีกเลี่ยงการถูกแสงแดดโดยตรง ความชื้น และความร้อนที่มากเกินไป
การส่งสินค้า:ส่งไปทั่วโลกทางอากาศโดย FedEx / DHL Expressให้การจัดส่งที่รวดเร็วและเชื่อถือได้


รหัสความเสี่ยง R21 - เป็นอันตรายเมื่อสัมผัสกับผิวหนัง
R36/38 - ระคายเคืองต่อดวงตาและผิวหนัง
R46 - อาจทำให้เกิดความเสียหายทางพันธุกรรมที่ถ่ายทอดทางพันธุกรรมได้
R62 - ความเสี่ยงที่เป็นไปได้ของภาวะเจริญพันธุ์บกพร่อง
R63 - ความเสี่ยงที่อาจเป็นอันตรายต่อเด็กในครรภ์
คำอธิบายด้านความปลอดภัย S25 - หลีกเลี่ยงการสัมผัสกับดวงตา
S26 - ในกรณีที่เข้าตา ให้ล้างออกทันทีด้วยน้ำปริมาณมาก และปรึกษาแพทย์
S36/37 - สวมชุดป้องกันและถุงมือที่เหมาะสม
S53 - หลีกเลี่ยงการสัมผัส - รับคำแนะนำพิเศษก่อนใช้
ดับเบิลยูจีเค เยอรมนี3
RTECS HA3840000
รหัส HS 2942000000
Gemcitabine Hydrochloride (CAS: 122111-03-9) เป็นยาไดฟลูออโรนิวคลีโอไซด์สังเคราะห์ที่มีฤทธิ์ต้านเมแทบอลิซึมและแอนตินีโอพลาสติกมันถูกวิจัยและพัฒนาโดย Eli Lilly and Company และได้รับการอนุมัติให้จดทะเบียนในแอฟริกาใต้ สวีเดน เนเธอร์แลนด์ ออสเตรเลีย และประเทศอื่นๆ ในปี 1995 สำนักงานคณะกรรมการอาหารและยาของสหรัฐอเมริกา (FDA) อนุมัติให้เป็นการบำบัดบรรทัดแรก สำหรับการรักษาทางคลินิกของมะเร็งปอดชนิดเซลล์ไม่เล็กและมะเร็งตับอ่อน
ในช่วงไม่กี่ปีที่ผ่านมา ยาใหม่ๆ เช่น Gemcitabine, Paclitaxel, Docetaxel, Vinorebine เป็นยาที่มีประสิทธิภาพสำหรับการรักษามะเร็งปอดชนิดเซลล์ไม่เล็ก (ตัวย่อ NSCLC)เมื่อเทียบกับยาเคมีบำบัดแบบดั้งเดิม ยาเหล่านี้มีข้อดีคือมีผลการรักษาสูงและมีความเป็นพิษต่ำเจมซิตาไบน์ ไฮโดรคลอไรด์เป็นยาต้านเมตาโบไลต์รุ่นใหม่และเป็นยาชนิดพิเศษสำหรับวัฏจักรเซลล์ โดยมีบทบาทสำคัญในขั้นตอนการสังเคราะห์ DNA ซึ่งก็คือเฟส S ของเซลล์ภายใต้เงื่อนไขบางประการ ยานี้สามารถป้องกันการลุกลามของเซลล์จากระยะ G1 ไปสู่ระยะ S และมีฤทธิ์ต้านมะเร็งที่แข็งแกร่ง มะเร็งปอดที่ไม่ใช่เซลล์ขนาดเล็ก (NSCLC)การศึกษาในต่างประเทศแสดงให้เห็นว่าประสิทธิภาพของการรักษาแบบเดี่ยวสำหรับ NSCLC ร่วมกับ Gemcitabine Hydrochloride อยู่ที่ประมาณ 18%~35% เท่านั้น ในขณะที่การรักษาร่วมกับ cisplatin ประสิทธิภาพของ NSCLC คือ 41.7%ใน NSCLC ขั้นสูง อัตราประสิทธิผลของ carboplatin คือ 16% ซึ่งคล้ายกับ cisplatin แต่มีความเป็นพิษต่ำ โดยเฉพาะอย่างยิ่งสำหรับปฏิกิริยาในทางเดินอาหาร การกดไขกระดูก และปฏิกิริยาที่เป็นพิษของไตและปลายประสาทเมื่อใช้ร่วมกับ carboplatin ทั้งคู่มีการทำงานร่วมกันและมีผลเสริม และสามารถสร้างผลการรักษาที่สูงขึ้นได้
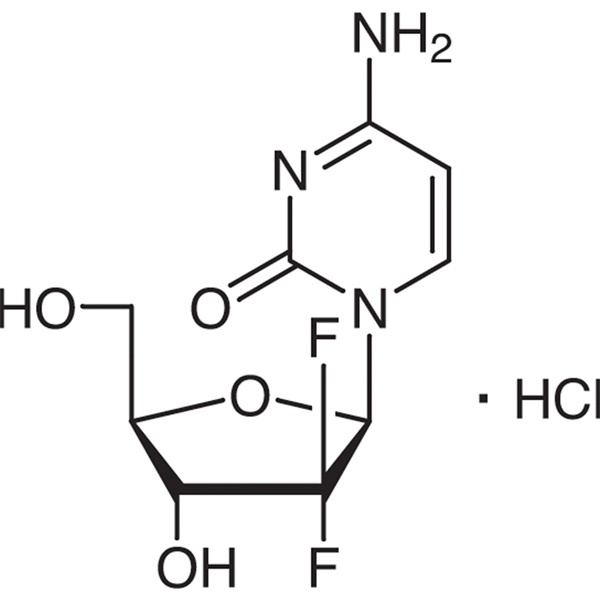
เจมซิตาบีน ไฮโดรคลอไรด์
C9H11F2N3O4·HCl 299.66
Cytidine, 2′-deoxy-2′,2′-difluro-, โมโนไฮโดรคลอไรด์
2′-ดีออกซี-2′,2′-ไดฟลูออโรไซทิดีน โมโนไฮโดรคลอไรด์ ( β-ไอโซเมอร์) [122111-03-9]
» Gemcitabine Hydrochloride ประกอบด้วย C9H11F2N3O4·HCl ไม่น้อยกว่าร้อยละ 97.5 และไม่เกินร้อยละ 101.5 ซึ่งคำนวณตามเกณฑ์ที่เป็นอยู่
[ข้อควรระวัง-Gemcitabine Hydrochloride เป็นสารที่เป็นพิษต่อเซลล์ที่มีศักยภาพควรใช้ความระมัดระวังอย่างยิ่งเพื่อป้องกันการสูดดมอนุภาคและสัมผัสกับผิวหนัง]
บรรจุภัณฑ์และการเก็บรักษา - เก็บรักษาในภาชนะที่แน่นหนา
การติดฉลาก - ในกรณีที่มีวัตถุประสงค์เพื่อใช้ในการเตรียมรูปแบบยาฉีด ฉลากระบุว่าเป็นหมันหรือต้องผ่านกระบวนการเพิ่มเติมในระหว่างการเตรียมรูปแบบยาฉีด
มาตรฐานอ้างอิง USP <11>-
USP ไซโตซีน RS
USP เอนโดทอกซิน RS
USP Gemcitabine ไฮโดรคลอไรด์ RS
บัตรประจำตัว-
A: การดูดซับอินฟราเรด <197K>
B: เป็นไปตามข้อกำหนดของการทดสอบคลอไรด์ <191>
การหมุนเฉพาะ <781S>: ระหว่าง +43 ถึง +50 ที่ 20
สารละลายทดสอบ: 10 มก. ต่อ มล.
pH <791>: ระหว่าง 2.0 ถึง 3.0 ในสารละลายที่มี 10 มก. ต่อมล.
สารตกค้างจากการจุดระเบิด <281>: ไม่เกิน 0.1%
โลหะหนัก วิธี I <231>: 0.001%
ความบริสุทธิ์ของโครมาโตกราฟี-
โซลูชัน A- ดำเนินการตามที่กำหนดสำหรับเฟสมือถือในการทดสอบ
สารละลาย B-เตรียมเมทานอลที่ผ่านการกรองและกำจัดก๊าซ
เฟสเคลื่อนที่-ใช้ส่วนผสมที่แปรผันของสารละลาย A และสารละลาย B ตามที่กำหนดภายใต้ระบบโครมาโตกราฟีทำการปรับเปลี่ยน หากจำเป็น (ดูความเหมาะสมของระบบภายใต้โครมาโตกราฟี 621)
วิธีแก้ปัญหาความเหมาะสมของระบบ-ดำเนินการตามที่กำหนดในการทดสอบ
สารละลายมาตรฐาน - ละลาย USP Gemcitabine Hydrochloride RS และ USP Cytosine RS ในปริมาณที่ชั่งน้ำหนักอย่างแม่นยำในน้ำ และเจือจางในเชิงปริมาณ หากจำเป็น เพื่อให้ได้สารละลายที่มีความเข้มข้นที่ทราบประมาณ 2 ไมโครกรัมต่อมิลลิลิตรของแต่ละสารละลาย
สารละลายทดสอบ-ถ่ายโอนเจมซิตาไบน์ไฮโดรคลอไรด์ประมาณ 50 มก. ที่ชั่งน้ำหนักอย่างแม่นยำไปยังขวดวัดปริมาตร 25 มล. ละลายและเจือจางด้วยน้ำต่อปริมาตร แล้วผสม
ระบบโครมาโตกราฟี (ดูโครมาโตกราฟี 621) -ดำเนินการตามคำแนะนำภายใต้การทดสอบโครมาโตกราฟีถูกตั้งโปรแกรมไว้ดังนี้
เวลา (นาที) สารละลาย A (%) สารละลาย B (%) สารละลาย
0–8 97 3 isocratic
8–13 97®50 3®50 การไล่ระดับสีเชิงเส้น
13–20 50 50 isocratic
20–25 50®97 50®3 ปรับสมดุลใหม่
โครมาโตกราฟโซลูชันความเหมาะสมของระบบ และบันทึกการตอบสนองสูงสุดตามที่กำหนดสำหรับขั้นตอน: เวลาการเก็บรักษาสัมพัทธ์คือประมาณ 0.5 สำหรับเจมซิตาไบน์-อะโนเมอร์ และ 1.0 สำหรับเจมซิตาไบน์ความละเอียด R ระหว่างเจมซิตาไบน์ -อะโนเมอร์และเจมซิตาบีนต้องไม่น้อยกว่า 8.0;และ tailing factor สำหรับ gemcitabine ไม่เกิน 1.5โครมาโตกราฟของสารละลายมาตรฐาน และบันทึกการตอบสนองสูงสุดตามที่กำหนดไว้สำหรับขั้นตอน: เวลาการกักเก็บสัมพัทธ์คือประมาณ 0.1 สำหรับไซโตซีนและ 1.0 สำหรับเจมซิตาบีนค่าเบี่ยงเบนมาตรฐานสัมพัทธ์สำหรับการฉีดซ้ำไม่เกิน 2.0%
ขั้นตอน-แยกใส่ปริมาตร (ประมาณ 20 µL) ของสารละลายมาตรฐานและสารละลายทดสอบลงในโครมาโตกราฟ บันทึกโครมาโตแกรม และวัดการตอบสนองสูงสุดทั้งหมดคำนวณเปอร์เซ็นต์ของไซโตซีนในส่วนของเจมซิตาบีนที่ได้จากสูตร:
2.5(ซีซี/วัตต์)(rt / rs)
โดยที่ Cc คือความเข้มข้นของ USP Cytosine RS ในสารละลายมาตรฐาน มีหน่วยเป็น µg ต่อ mLW คือน้ำหนักของเจมซิตาบีนที่ได้รับในหน่วยมิลลิกรัมrt คือการตอบสนองสูงสุดสำหรับไซโตซีนในสารละลายทดสอบและ rs คือการตอบสนองของไซโตซีนในสารละลายมาตรฐาน: พบไซโตซีนไม่เกิน 0.1%คำนวณเปอร์เซ็นต์ของสิ่งเจือปนแต่ละอย่างนอกเหนือจากไซโตซีนในส่วนของเจมซิตาบีนที่ได้จากสูตร:
2.5(Cs / W)(ri / rs)
โดยที่ Cs คือความเข้มข้นของ USP Gemcitabine Hydrochloride RS ในสารละลายมาตรฐาน มีหน่วยเป็น µg ต่อ mLW คือน้ำหนักของเจมซิตาบีนที่ได้รับในหน่วยมิลลิกรัมri คือการตอบสนองสูงสุดสำหรับสิ่งเจือปนแต่ละอย่างในสารละลายทดสอบและ rs คือการตอบสนองเนื่องจากเจมซิตาไบน์ในสารละลายมาตรฐาน: ไม่เกิน 0.1% ของเจมซิตาไบน์ -อะโนเมอร์หรือสิ่งเจือปนอื่นใดที่พบ;และผลรวมของสิ่งสกปรกทั้งหมดไม่เกิน 0.2%แยกออกจากผลรวมของสิ่งเจือปนทั้งหมด พีคใดๆ ที่ต่ำกว่าขีดจำกัดของปริมาณ (0.02%)
ข้อกำหนดอื่น ๆ - เมื่อฉลากระบุว่า Gemcitabine Hydrochloride ปราศจากเชื้อ เป็นไปตามข้อกำหนดสำหรับสารเอนโดทอกซินจากแบคทีเรียและความปราศจากเชื้อภายใต้ Gemcitabine for Injectionที่ฉลากระบุว่า Gemcitabine Hydrochloride ต้องผ่านกระบวนการเพิ่มเติมในระหว่างการเตรียมรูปแบบยาฉีด ซึ่งเป็นไปตามข้อกำหนดสำหรับสารเอนโดท็อกซินจากแบคทีเรียภายใต้ Gemcitabine for Injection
การทดสอบ-
เฟสเคลื่อนที่-เตรียมสารละลายที่กรองและกำจัดแก๊สที่มีโมโนเบสิกโซเดียมฟอสเฟต 13.8 กรัมและกรดฟอสฟอริก 2.5 มล. ในน้ำ 1,000 มล.[หมายเหตุ-ค่า pH ของสารละลายนี้อยู่ระหว่าง 2.4 ถึง 2.6]
สารละลายที่เหมาะสมกับระบบ-ถ่ายโอนเจมซิตาไบน์ไฮโดรคลอไรด์ประมาณ 10 มก. ลงในขวดเล็ก เติมสารละลาย 4 มล. ที่มีโพแทสเซียมไฮดรอกไซด์ 168 มก. ต่อเมทานอล 1 มล. ปิดฝาให้แน่น แล้วโซนิเคตอุ่นที่อุณหภูมิ 55 เป็นเวลา 6 ถึง 16 ชั่วโมง ปล่อยให้เย็น และถ่ายโอนเนื้อหาไปยังขวดวัดปริมาตร 100 มล. โดยล้างด้วยกรดฟอสฟอริก 1% (v/v) อย่างต่อเนื่องเจือจางด้วยกรดฟอสฟอริก 1% ต่อปริมาตรแล้วผสม[หมายเหตุ-สารละลายนี้มีเจมซิตาบีน α-anomer ประมาณ 0.02 มก. ต่อมล.]
การเตรียมมาตรฐาน - ละลาย USP Gemcitabine Hydrochloride RS ในปริมาณที่ชั่งน้ำหนักอย่างถูกต้องในน้ำ และเจือจางในเชิงปริมาณ และทีละขั้นตอนหากจำเป็น ด้วยน้ำ เพื่อให้ได้สารละลายที่มีความเข้มข้นที่ทราบประมาณ 0.1 มก. ต่อมล.
การเตรียมการทดสอบ-ถ่ายโอนเจมซิตาไบน์ไฮโดรคลอไรด์ประมาณ 20 มก. ที่ชั่งน้ำหนักอย่างแม่นยำไปยังขวดวัดปริมาตร 200 มล. ละลายและเจือจางด้วยน้ำต่อปริมาตร แล้วผสม
ระบบโครมาโตกราฟี (ดูโครมาโตกราฟี <621>)-โครมาโตกราฟีแบบของเหลวติดตั้งเครื่องตรวจจับขนาด 275 นาโนเมตรและคอลัมน์ขนาด 4.6 มม. × 25 ซม. ที่บรรจุ L7 ขนาด 5 µmอัตราการไหลประมาณ 1.2 มล. ต่อนาทีโครมาโตกราฟโซลูชันความเหมาะสมของระบบ และบันทึกการตอบสนองสูงสุดตามที่กำหนดสำหรับขั้นตอน: ความละเอียด R ระหว่างเจมซิตาไบน์ -อะโนเมอร์และเจมซิตาไบน์ต้องไม่น้อยกว่า 8.0;และ tailing factor ที่กำหนดจาก gemcitabine ไม่เกิน 1.5โครมาโตกราฟการเตรียมมาตรฐาน และบันทึกการตอบสนองสูงสุดตามที่กำหนดสำหรับขั้นตอน: ส่วนเบี่ยงเบนมาตรฐานสัมพัทธ์สำหรับการฉีดซ้ำไม่เกิน 1.0%
ขั้นตอน-แยกฉีดสารเตรียมมาตรฐานและสารเตรียมปริมาณเท่ากัน (ประมาณ 20 µL) ลงในโครมาโตกราฟ บันทึกโครมาโตแกรม และวัดการตอบสนองสำหรับพีคหลักคำนวณปริมาณ C9H11F2N3O4·HCl ในหน่วยมิลลิกรัมของเจมซิตาไบน์ไฮโดรคลอไรด์ตามสูตร:
200C(อาร์ยู / อาร์เอส)
โดยที่ C คือความเข้มข้นในหน่วยมิลลิกรัมต่อมิลลิลิตรของ USP Gemcitabine Hydrochloride RS ในการเตรียมมาตรฐานและ rU และ rs เป็นการตอบสนองสูงสุดที่ได้รับจากการเตรียมการทดสอบและการเตรียมมาตรฐานตามลำดับ
-

Gemcitabine Hydrochloride CAS 122111-03-9 API ยู...
-

เจมซิตาบีน CAS 95058-81-4 การทดสอบ 98.0~102.0%
-

เซโฟเทียมไฮโดรคลอไรด์ CAS 66309-69-1 API USP S...
-

Doxorubicin Hydrochloride CAS 25316-40-9 API US...
-

Enalapril Maleate CAS 76095-16-4 การทดสอบ 98.0~102...
-

Guanfacine ไฮโดรคลอไรด์ Guanfacine HCl CAS 291...
-

Irinotecan Hydrochloride CAS 100286-90-6 ความบริสุทธิ์...
-

Levetiracetam LEV CAS 102767-28-2 API โรงงาน U...
-

Naltrexone Hydrochloride CAS 16676-29-2 API USP...
-

นอสคาปีน ไฮโดรคลอไรด์ ไฮเดรต CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99.0~100.5% USP B...
-

Darunavir CAS 206361-99-1 Anti-HIV ความบริสุทธิ์ ≥99.0...
-

Ezetimibe CAS 163222-33-1 ความบริสุทธิ์ 98.5%~102.0% (...
-

Lasofoxifene Tartrate CAS 190791-29-8 Chiral Pu...
-

Bortezomib CAS 179324-69-7 ความบริสุทธิ์ ≥99.0% (HPLC)...
-

CAS 274901-16-5 ความบริสุทธิ์ ≥99.0% (HPLC) API