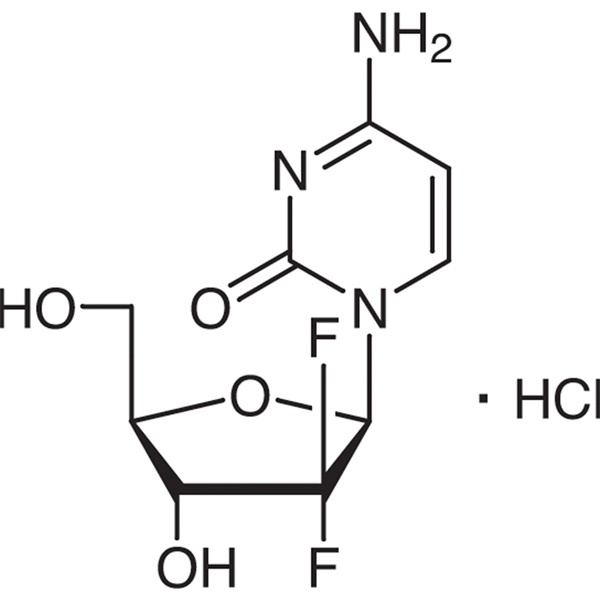
Gemsitabin Hidroklorür CAS 122111-03-9 API USP35 Standardı
Ruifu Chemical, yüksek kaliteli ticari üretim ile Gemsitabin Hidroklorürün (CAS: 122111-03-9) lider üreticisidir.Ruifu Chemical, dünya çapında teslimat, rekabetçi fiyat, mükemmel hizmet, küçük ve toplu miktarlar sağlayabilir.Gemsitabin Hidroklorür satın alın,Please contact: alvin@ruifuchem.com
| Kimyasal ad | Gemsitabin Hidroklorür |
| Eş anlamlı | Gemsitabin HCI;2'-Deoksi-2',2'-Diflorositidin Hidroklorür;dFdC;dFdCyd;Gemzar;LY188011 Hidroklorür;Gemcitera;Gemsar |
| CAS numarası | 122111-03-9 |
| İlgili CAS | 95058-81-4 - Serbest Taban |
| Stok durumu | Stokta, Üretim Kapasitesi 5 Ton |
| Moleküler formül | C9H12ClF2N3O4 |
| Moleküler ağırlık | 299,66 |
| Erime noktası | >250°C |
| Nakliye koşulları | Ortam Sıcaklığında |
| COA ve MSDS | Mevcut |
| Menşei | Şangay, Çin |
| Marka | Ruifu Kimyasal |
| Öğe | Özellikler | Sonuçlar |
| Dış görünüş | Beyaz Kristal Toz, Kokusuz | Uyumludur |
| çözünürlük | Suda çözünür, metanolde az çözünür, asetonda pratik olarak çözünmez | Uyumludur |
| Kimlik IR | IR spektrumu aşağıdakilerle uyumlu olmalıdır: referans standardınınki | Uyumludur |
| Tanımlama Klorür | Pozitif.Klorür testlerinin gereksinimlerini karşılar | Uyumludur |
| Çözümün görünüşü | Çözüm S açık ve daha yoğun değil BY7 referans çözümünden daha renkli | Uyumludur |
| pH | 2.0~3.0 | 2.6 |
| Spesifik Döndürme [α]20/D | +43,0° ila +50,0° | +47.5° |
| Ağır Metaller (Pb) | ≤10ppm | <10ppm |
| Kurutma kaybı | ≤1.00% | %0,3 |
| Ateşleme Kalıntısı | ≤0,10% | %0,03 |
| İlgili Maddeler | ||
| sitozin | ≤0,10% | %0.01 |
| α-İzomer | ≤0,10% | %0.01 |
| Diğer Safsızlıklar | ≤0,10% | %0,04 |
| Toplam safsızlıklar | ≤0,20% | %0,1 |
| Artık Çözücüler | ||
| Metanol | ≤0,30% | Algılanmadı |
| toluen | ≤0,01% | Algılanmadı |
| diklorometan | ≤0,01% | Algılanmadı |
| aseton | ≤0,50% | %0,1 |
| Tahlil | %97,5~%101,5 (Kuru Baz üzerinden hesaplanmıştır) | %99,9 |
| Çözüm | USP35 Standardına uygundur | |
paket:Şişe, Alüminyum folyo çanta, 25kg/Karton Davul veya müşterinin ihtiyacına göre.
Saklama Durumu:Kabı sıkıca kapalı tutun ve uyumsuz maddelerden uzak, serin, kuru ve iyi havalandırılan bir depoda saklayın.Doğrudan güneş ışığına, neme ve aşırı sıcağa maruz bırakmaktan kaçının.
Nakliye:FedEx / DHL Express ile hava yoluyla dünyanın her yerine teslimat yapın.Hızlı ve güvenilir teslimat sağlayın.


Risk Kodları R21 - Cilt ile temasında sağlığa zararlıdır
R36/38 - Gözleri ve cildi tahriş edici.
R46 - Kalıtsal genetik hasara neden olabilir
R62 - Olası doğurganlık riski
R63 - Doğmamış çocuğa olası zarar verme riski
Güvenlik Tanımı S25 - Göz ile temasından kaçının.
S26 - Göz ile temasında hemen bol su ile yıkayınız ve doktora başvurunuz.
S36/37 - Uygun koruyucu giysi ve eldiven giyin.
S53 - Maruz kalmaktan kaçının - kullanmadan önce özel talimatları alın.
WGK Almanya 3
RTECS HA3840000
HS Kodu 2942000000
Gemsitabin Hidroklorür (CAS: 122111-03-9), anti-metabolik ve antineoplastik olan sentetik yeni bir difloro nükleosid ilaçtır.Eli Lilly and Company tarafından araştırılıp geliştirilmiştir ve 1995 yılında Güney Afrika, İsveç, Hollanda, Avustralya ve diğer ülkelerde listelenmesi onaylanmıştır. Amerika Birleşik Devletleri Gıda ve İlaç İdaresi (FDA) bunu birinci basamak tedavi olarak onayladı. küçük hücreli dışı akciğer kanseri ve pankreas kanserinin klinik tedavisi için.
Son yıllarda Gemcitabine, Paclitaxel, Docetaxel, Vinorebine gibi yeni ilaçlar küçük hücreli dışı akciğer kanserinin (kısaltılmış NSCLC) tedavisinde etkili ilaçlardır.Geleneksel kemoterapi ilaçları ile karşılaştırıldığında, bu ilaçlar yüksek iyileştirici etki ve düşük toksisite avantajlarına sahiptir.Gemsitabin Hidroklorür, yeni nesil bir anti-metabolit ilacı ve hücre döngüsü için özel bir ilaç türüdür ve hücrelerin DNA sentezi fazında, yani hücrelerin S fazında önemli rol oynar.Belirli koşullar altında bu ilaç, hücrelerin G1 fazından S fazına ilerlemesini önleyebilir ve küçük hücreli olmayan akciğer kanseri (KHDAK) için güçlü bir anti-kanser aktivitesine sahip olabilir.Yabancı çalışmalar, KHDAK için sadece Gemsitabin Hidroklorür ile tek tedavinin etkinliğinin yaklaşık %18~%35 olduğunu, sisplatin ile kombine tedavinin ise KHDAK için etkinliğin %41,7 olduğunu göstermiştir.İlerlemiş KHDAK'de etkili karboplatin oranı %16'dır, karboplatin sisplatine benzer, ancak düşük toksisiteye sahiptir, özellikle gastrointestinal reaksiyonlar, kemik iliği baskılanması ve böbrek ve sinir uçlarının toksik reaksiyonu için.Karboplatin ile kombinasyon halinde, her ikisi de karşılıklı koordinasyona ve aditif etkiye sahiptir ve daha yüksek iyileştirici etkiler üretebilir.
Gemsitabin Hidroklorür
C9H11F2N3O4·HCl 299,66
Sitidin, 2'-deoksi-2',2'-difloro-, monohidroklorür.
2'-Deoksi-2',2'-diflorositidin monohidroklorür ( β-izomer) [122111-03-9].
» Gemsitabin Hidroklorür, olduğu gibi hesaplandığında en az yüzde 97,5 ve en fazla yüzde 101,5 C9H11F2N3O4·HCl içerir.
[Dikkat-Gemsitabin Hidroklorür güçlü bir sitotoksik ajandır.Parçacıkların solunmaması ve cildin maruz kalmaması için büyük özen gösterilmelidir.]
Paketleme ve saklama-Sıkı kaplarda muhafaza edin.
Etiketleme-Enjekte edilebilir dozaj formlarının hazırlanmasında kullanılması amaçlanan etiket, steril olduğunu veya enjekte edilebilir dozaj formlarının hazırlanması sırasında daha ileri işlemlere tabi tutulması gerektiğini belirtir.
USP Referans standartları <11>-
USP Sitozin RS
USP Endotoksin RS
USP Gemsitabin Hidroklorür RS
Tanılama-
A: Kızılötesi Soğurma <197K>.
B: Klorür <191> için testlerin gereksinimlerini karşılar.
Spesifik dönüş <781S>: +43 ile +50 arasında, 20'de.
Test solüsyonu: mL başına 10 mg.
pH <791>: 2,0 ve 3,0 arasında, mL başına 10 mg içeren bir solüsyonda.
Tutuşma kalıntısı <281>: %0,1'den fazla değil.
Ağır metaller, Yöntem I <231>: %0,001.
kromatografik saflık-
Çözüm A- Tahlildeki Mobil faz için belirtilen şekilde devam edin.
Çözüm B-Filtrelenmiş ve gazı alınmış metanol hazırlayın.
Mobil faz-Kromatografik sistem altında yönlendirildiği gibi, Çözelti A ve Çözelti B'nin değişken karışımlarını kullanın.Gerekirse ayarlamalar yapın (Kromatografi 621 altında Sistem Uygunluğuna bakın).
Sistem uygunluk çözümü-Tahlilde belirtildiği gibi devam edin.
Standart solüsyon-Doğru şekilde tartılmış miktarda USP Gemsitabin Hidroklorür RS ve USP Sitosin RS'yi suda çözün ve her birinin mL'si başına yaklaşık 2 µg bilinen bir konsantrasyona sahip bir solüsyon elde etmek için kantitatif olarak ve gerekirse kademeli olarak seyreltin.
Test solüsyonu-Doğru şekilde tartılmış yaklaşık 50 mg Gemsitabin Hidroklorürü 25 mL'lik ölçülü bir şişeye aktarın, içinde çözün ve hacme kadar su ile seyreltin ve karıştırın.
Kromatografik sistem (bkz. Kromatografi 621)-Tahlil altında belirtilen şekilde devam edin.Kromatograf aşağıdaki gibi programlanmıştır.
Süre (dakika) Çözüm A (%) Çözüm B (%) Elüsyon
0–8 97 3 izokratik
8–13 97®50 3®50 lineer gradyan
13–20 50 50 izokratik
20–25 50®97 50®3 yeniden dengeleme
Sistem uygunluk solüsyonunun kromatografisini yapın ve Prosedür için yönlendirildiği şekilde tepe tepkilerini kaydedin: bağıl alıkonma süreleri gemsitabin-anomer için yaklaşık 0.5 ve gemsitabin için 1.0'dır;gemsitabin-anomer ve gemsitabin arasındaki çözünürlük, R, 8.0'den az değildir;ve gemsitabin için kuyruk faktörü 1.5'ten fazla değildir.Standart solüsyonu kromatografiye tabi tutun ve Prosedür için belirtilen şekilde pik tepkileri kaydedin: bağıl alıkonma süreleri sitozin için yaklaşık 0,1 ve gemsitabin için 1,0'dır;tekrarlanan enjeksiyonlar için göreli standart sapma %2,0'den fazla değildir.
Prosedür-Bir hacim (yaklaşık 20 µL) Standart solüsyon ve Test solüsyonunu kromatografa ayrı ayrı enjekte edin, kromatogramı kaydedin ve tüm pik tepkilerini ölçün.Aşağıdaki formüle göre alınan Gemsitabin kısmındaki sitozin yüzdesini hesaplayın:
2,5(Cc / W)(rt / rs)
burada Cc, Standart solüsyondaki USP Cytosine RS konsantrasyonudur, mL başına µg cinsinden;W, alınan Gemsitabinin mg cinsinden ağırlığıdır;rt, Test solüsyonundaki sitozin için en yüksek tepkidir;ve rs, Standart solüsyondaki sitozin yanıtıdır: %0,1'den fazla sitozin bulunmaz.Gemsitabin'in aşağıdaki formüle göre alınan kısmındaki sitozin dışındaki her bir safsızlığın yüzdesini hesaplayın:
2,5(S / K)(ri / rs)
burada Cs, Standart solüsyondaki USP Gemsitabin Hidroklorür RS'nin mL başına µg cinsinden konsantrasyonudur;W, alınan Gemsitabinin mg cinsinden ağırlığıdır;ri, Test solüsyonundaki her safsızlık için en yüksek tepkidir;ve rs, Standart solüsyonda gemsitabinden kaynaklanan yanıttır: %0,1'den fazla gemsitabin -anomer veya başka herhangi bir safsızlık bulunmaz;ve tüm safsızlıkların toplamı %0,2'den fazla değildir.Kantitasyon sınırının (%0,02) altındaki tüm pikleri tüm safsızlıkların toplamından hariç tutun.
Diğer gereksinimler-Etikette Gemsitabin Hidroklorürün steril olduğu belirtildiğinde, Gemsitabin Enjeksiyonluk altında Bakteriyel endotoksinler ve Sterilite gerekliliklerini karşılar.Etiketin, enjekte edilebilir dozaj formlarının hazırlanması sırasında Gemsitabin Hidroklorürün daha ileri işlemlere tabi tutulması gerektiğini belirttiği durumlarda, Gemsitabin Enjeksiyonluk altındaki Bakteriyel endotoksinler gerekliliklerini karşılamaktadır.
Tahlil-
Mobil faz-1000 mL su içinde 13,8 g monobazik sodyum fosfat ve 2,5 mL fosforik asit içeren filtrelenmiş ve gazı alınmış bir çözelti hazırlayın.[not-Bu çözeltinin pH'ı 2,4 ile 2,6 arasındadır.]
Sistem uygunluk solüsyonu-Küçük bir şişeye yaklaşık 10 mg Gemsitabin Hidroklorür aktarın, her mL metanol için 168 mg potasyum hidroksit içeren 4 mL solüsyon ekleyin, kapağını sıkıca kapatın ve sonikasyon uygulayın.55°C'de 6 ila 16 saat ısıtın, soğumaya bırakın ve içeriği art arda %1 (h/h) fosforik asitle yıkayarak 100 mL'lik ölçülü bir şişeye aktarın.Hacme göre %1 fosforik asit ile seyreltin ve karıştırın.[not-Bu çözelti, mL gemsitabin α-anomer başına yaklaşık 0,02 mg içerir.]
Standart hazırlık-Doğru şekilde tartılmış miktarda USP Gemsitabin Hidroklorür RS'yi suda eritin ve kantitatif olarak ve gerekirse kademeli olarak suyla seyrelterek, mL başına yaklaşık 0,1 mg bilinen bir konsantrasyona sahip bir çözelti elde edin.
Tahlil hazırlığı-Doğru şekilde tartılmış yaklaşık 20 mg Gemsitabin Hidroklorürü 200 mL'lik ölçülü bir şişeye aktarın, içinde çözün ve hacme kadar su ile seyreltin ve karıştırın.
Kromatografik sistem (bkz. Kromatografi <621>)-Sıvı kromatograf, 275 nm'lik bir detektör ve 5 µm L7 dolgusu içeren 4,6 mm × 25 cm'lik bir kolon ile donatılmıştır.Akış hızı dakikada yaklaşık 1,2 mL'dir.Sistem uygunluk solüsyonunun kromatografisini yapın ve Prosedür için belirtilen şekilde pik yanıtları kaydedin: gemsitabin-anomer ve gemsitabin arasındaki çözünürlük, R, 8.0'dan az değildir;ve gemsitabinden belirlenen kuyruk faktörü 1,5'ten fazla değildir.Standart preparasyonun kromatografisini yapın ve en yüksek yanıtları Prosedürde belirtilen şekilde kaydedin: tekrarlanan enjeksiyonlar için bağıl standart sapma %1,0'den fazla değildir.
Prosedür-Standart preparattan ve Tahlil preparatından eşit hacimlerde (yaklaşık 20 µL) kromatografa ayrı ayrı enjekte edin, kromatogramları kaydedin ve ana pikler için yanıtları ölçün.Gemsitabin Hidroklorürün aşağıdaki formüle göre alınan kısmındaki C9H11F2N3O4·HCl miktarını mg cinsinden hesaplayın:
200C(rU / rS)
burada C, Standart preparasyonda USP Gemsitabin Hidroklorür RS'nin mL başına mg cinsinden konsantrasyonudur;ve rU ve rS, sırasıyla Tahlil preparasyonundan ve Standart preparasyondan elde edilen pik tepkilerdir.
-

Gemsitabin Hidroklorür CAS 122111-03-9 API U...
-

Gemsitabin CAS 95058-81-4 Testi %98,0~102,0
-

Cefotiam Hidroklorür CAS 66309-69-1 API USP S...
-

Doksorubisin Hidroklorür CAS 25316-40-9 API ABD...
-

Enalapril Maleat CAS 76095-16-4 Test 98.0~102...
-

Guanfasin Hidroklorür Guanfasin HCI CAS 291...
-

İrinotekan Hidroklorür CAS 100286-90-6 Saflık...
-

Levetiracetam LEV CAS 102767-28-2 API Fabrika U...
-

Naltrekson Hidroklorür CAS 16676-29-2 API USP...
-

Noscapine Hidroklorür Hidrat CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 %99,0~100,5 USP B...
-

Darunavir CAS 206361-99-1 Anti-HIV Saflık ≥99,0...
-

Ezetimibe CAS 163222-33-1 Saflık %98,5~%102,0 (...
-

Lasofoxifene Tartrate CAS 190791-29-8 Kiral Pu...
-

Bortezomib CAS 179324-69-7 Saflık ≥99,0% (HPLC)...
-

CAS 274901-16-5 Saflık ≥99,0% (HPLC) API