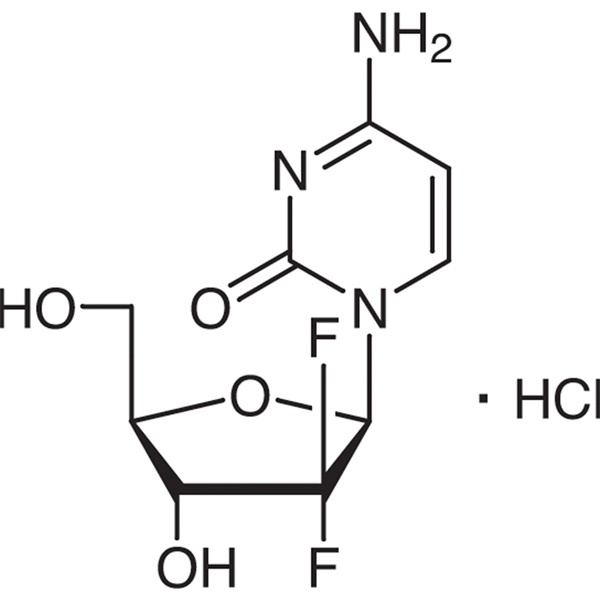
Гемцитабіну гідрохлорид CAS 122111-03-9 Стандарт API USP35
Ruifu Chemical є провідним виробником гемцитабіну гідрохлориду (CAS: 122111-03-9) з високоякісним комерційним виробництвом.Ruifu Chemical може забезпечити доставку по всьому світу, конкурентоспроможну ціну, відмінний сервіс, малі та оптові обсяги.Придбати гемцитабін гідрохлорид,Please contact: alvin@ruifuchem.com
| Хімічна назва | Гемцитабіну гідрохлорид |
| Синоніми | Гемцитабін HCl;2'-дезокси-2',2'-дифтороцитидину гідрохлорид;dFdC;dFdCyd;Гемзар;LY188011 гідрохлорид;гемцитера;Гемсар |
| Номер CAS | 122111-03-9 |
| Пов’язаний CAS | 95058-81-4 - Безкоштовна база |
| Стан запасів | В наявності, виробнича потужність 5 тонн |
| Молекулярна формула | C9H12ClF2N3O4 |
| Молекулярна вага | 299,66 |
| Точка плавлення | >250 ℃ |
| Умови доставки | Нижче температури навколишнього середовища |
| COA & MSDS | в наявності |
| Походження | Шанхай, Китай |
| Бренд | Ruifu Chemical |
| Пункт | Технічні характеристики | Результати |
| Зовнішній вигляд | Білий кристалічний порошок без запаху | Відповідає |
| Розчинність | Розчинний у воді, слабо розчинний у метанолі, практично нерозчинний в ацетоні | Відповідає |
| Ідентифікація ІЧ | ІЧ-спектр повинен відповідати еталонного стандарту | Відповідає |
| Ідентифікація Хлорид | Позитивний.Він відповідає вимогам випробувань на хлорид | Відповідає |
| Зовнішній вигляд розчину | Розчин S прозорий і не більш інтенсивний забарвлений, ніж еталонний розчин BY7 | Відповідає |
| pH | 2,0~3,0 | 2.6 |
| Питоме обертання [α]20/D | від +43,0° до +50,0° | +47,5° |
| Важкі метали (Pb) | ≤10 ppm | <10 ppm |
| Втрати при висиханні | ≤1,00% | 0,3% |
| Залишок після запалювання | ≤0,10% | 0,03% |
| Споріднені речовини | ||
| Цитозин | ≤0,10% | 0,01% |
| α-Ізомер | ≤0,10% | 0,01% |
| Будь-які інші домішки | ≤0,10% | 0,04% |
| Загальна кількість домішок | ≤0,20% | 0,1% |
| Залишкові розчинники | ||
| метанол | ≤0,30% | Не виявлено |
| Толуол | ≤0,01% | Не виявлено |
| дихлорметан | ≤0,01% | Не виявлено |
| ацетон | ≤0,50% | 0,1% |
| аналіз | 97,5%~101,5% (у розрахунку на висушену основу) | 99,9% |
| Висновок | Відповідає стандарту USP35 | |
пакет:Пляшка, мішок з алюмінієвої фольги, 25 кг/картонний барабан або відповідно до вимог замовника.
Умови зберігання:Тримайте контейнер щільно закритим і зберігайте в прохолодному, сухому та добре вентильованому складі подалі від несумісних речовин.Уникайте впливу прямих сонячних променів, вологи та надмірного тепла.
Доставка:Доставка по всьому світу повітряним транспортом за допомогою FedEx / DHL Express.Забезпечуємо швидку та надійну доставку.


Коди ризику R21 - Шкідливий при контакті зі шкірою
R36/38 - Подразнює очі та шкіру.
R46 - Може викликати спадкові генетичні пошкодження
R62 - Можливий ризик порушення фертильності
R63 - Можливий ризик заподіяння шкоди ненародженій дитині
Опис безпеки S25 - Уникайте контакту з очима.
S26 - У разі потрапляння в очі негайно промити великою кількістю води та звернутися до лікаря.
S36/37 - Одягайте відповідний захисний одяг і рукавички.
S53 - Уникати впливу - отримати спеціальні інструкції перед використанням.
WGK Німеччина 3
RTECS HA3840000
Код HS 2942000000
Гемцитабіну гідрохлорид (CAS: 122111-03-9) є новим синтетичним дифторнуклеозидним препаратом, який є антиметаболічним і протипухлинним.Його досліджено та розроблено компанією Eli Lilly and Company та схвалено для включення до списку в Південній Африці, Швеції, Нідерландах, Австралії та інших країнах у 1995 році. Управління з контролю за продуктами й ліками США (FDA) схвалило його як терапію першої лінії. для клінічного лікування недрібноклітинного раку легені та раку підшлункової залози.
В останні роки нові препарати, такі як гемцитабін, паклітаксел, доцетаксел, віноребін, є ефективними препаратами для лікування недрібноклітинного раку легенів (скорочено НМРЛ).У порівнянні з традиційними хіміотерапевтичними препаратами ці препарати мають переваги високого лікувального ефекту та низької токсичності.Гемцитабіну гідрохлорид - це препарат нового покоління проти метаболітів і тип спеціального препарату для клітинного циклу, який відіграє важливу роль у фазі синтезу ДНК, а саме S-фазі клітин.За певних умов цей лікарський засіб може запобігти прогресуванню клітин із фази G1 у фазу S і мати сильну протиракову дію щодо недрібноклітинного раку легенів (НМРЛ).Іноземні дослідження показали, що ефективність одноразового лікування НДКРЛ лише гемцитабіну гідрохлоридом становить близько 18%~35%, тоді як при комбінованому лікуванні цисплатином ефективність НДКРЛ становить 41,7%.При поширеному НДКРЛ ефективна швидкість карбоплатину становить 16%, що подібно до цисплатину, але має низьку токсичність, особливо щодо шлунково-кишкових реакцій, пригнічення кісткового мозку та токсичної реакції нирок і нервових закінчень.У поєднанні з карбоплатином обидва вони мають взаємну координацію та адитивний ефект, і можуть мати більш високі лікувальні ефекти.
Гемцитабіну гідрохлорид
C9H11F2N3O4·HCl 299,66
Цитидин, 2'-дезокси-2',2'-дифлуро-, моногідрохлорид.
2'-Дезокси-2',2'-дифтороцитидин моногідрохлорид (β-ізомер) [122111-03-9].
» Гемцитабіну гідрохлорид містить не менше ніж 97,5 відсотка та не більше 101,5 відсотка C9H11F2N3O4·HCl, розраховане на основі «як є».
[Обережно: гемцитабіну гідрохлорид є потужним цитотоксичним агентом.Необхідно бути дуже обережним, щоб запобігти вдиханню частинок і впливу на шкіру.]
Упаковка та зберігання - зберігати в герметичній тарі.
Маркування. Якщо препарат призначений для приготування лікарських форм для ін’єкцій, на етикетці зазначено, що він стерильний або має бути підданий подальшій обробці під час приготування лікарських форм для ін’єкцій.
Довідкові стандарти USP <11>-
USP Цитозин RS
USP Ендотоксин RS
USP гемцитабіну гідрохлорид RS
Ідентифікація-
A: Інфрачервоне поглинання <197K>.
B: Він відповідає вимогам випробувань на хлорид <191>.
Питоме обертання <781S>: між +43 і +50, при 20.
Досліджуваний розчин: 10 мг на мл.
pH <791>: від 2,0 до 3,0, у розчині, що містить 10 мг на мл.
Залишок при прожарюванні <281>: не більше 0,1%.
Важкі метали, метод I <231>: 0,001%.
Хроматографічна чистота-
Розчин A- Продовжуйте, як зазначено для рухомої фази в аналізі.
Розчин B-Приготуйте відфільтрований і дегазований метанол.
Рухома фаза. Використовуйте змінні суміші розчину A та розчину B відповідно до вказівок хроматографічної системи.За потреби внесіть коригування (див. Придатність системи у розділі Хроматографія 621).
Розчин для перевірки придатності системи - продовжуйте, як зазначено в аналізі.
Стандартний розчин. Розчиніть точно зважену кількість USP гемцитабіну гідрохлориду RS та USP Cytosine RS у воді та розведіть кількісно та поетапно, якщо необхідно, щоб отримати розчин із відомою концентрацією приблизно 2 мкг на мл кожного.
Досліджуваний розчин. Перенесіть близько 50 мг гемцитабіну гідрохлориду, точно зважених, у 25-мл мірну колбу, розчиніть і розведіть водою до об’єму та перемішайте.
Хроматографічна система (див. Хроматографія 621) - продовжуйте, як зазначено в розділі «Аналіз».Хроматограф програмується наступним чином.
Час (хвилини) Розчин A (%) Розчин B (%) Елюювання
0–8 97 3 ізократичний
8–13 97®50 3®50 лінійний градієнт
13–20 50 50 рівнократний
20–25 50®97 50®3 повторне врівноваження
Хроматографуйте розчин для перевірки придатності системи та зафіксуйте пікові відповіді відповідно до вказівок для процедури: відносний час утримання становить приблизно 0,5 для -аномера гемцитабіну та 1,0 для гемцитабіну;роздільна здатність, R, між гемцитабін-аномером і гемцитабіном становить не менше 8,0;а коефіцієнт хвоста для гемцитабіну становить не більше 1,5.Хроматографуйте стандартний розчин і запишіть пікові відповіді відповідно до вказівок для процедури: відносний час утримання становить приблизно 0,1 для цитозину та 1,0 для гемцитабіну;відносне стандартне відхилення для повторних ін’єкцій становить не більше 2,0%.
Процедура. Окремо введіть об’єм (приблизно 20 мкл) стандартного розчину та досліджуваного розчину в хроматограф, запишіть хроматограму та виміряйте всі пікові відповіді.Обчислюємо відсоток цитозину у взятій порції гемцитабіну за формулою:
2,5 (Cc / W) (rt / rs)
де Cc — концентрація USP Cytosine RS у стандартному розчині, мкг на мл;W — маса взятого гемцитабіну в мг;rt – пікова відповідь для цитозину в досліджуваному розчині;rs – відповідь на цитозин у стандартному розчині: виявляється не більше 0,1% цитозину.Обчисліть відсоток кожної домішки, окрім цитозину, у частці гемцитабіну, взятої за формулою:
2,5(Cs / W)(ri / rs)
де Cs — концентрація USP гемцитабіну гідрохлориду RS у стандартному розчині, мкг на мл;W — маса взятого гемцитабіну в мг;ri – піковий відгук для кожної домішки в досліджуваному розчині;rs – відповідь на гемцитабін у стандартному розчині: не більше 0,1% гемцитабіну -аномера або будь-якої іншої окремої домішки виявлено;а сума всіх домішок не більше 0,2%.Виключіть із суми всіх домішок будь-які піки, які знаходяться нижче межі кількісного визначення (0,02%).
Інші вимоги. Якщо на етикетці вказано, що гемцитабін гідрохлорид стерильний, він відповідає вимогам щодо бактеріальних ендотоксинів і стерильності під гемцитабіном для ін’єкцій.Якщо на етикетці вказано, що гемцитабіну гідрохлорид необхідно піддати подальшій обробці під час приготування ін’єкційних лікарських форм, він відповідає вимогам до бактеріальних ендотоксинів у Гемцитабіну для ін’єкцій.
аналіз-
Рухома фаза. Приготуйте відфільтрований і дегазований розчин, що містить 13,8 г одноосновного фосфату натрію та 2,5 мл фосфорної кислоти в 1000 мл води.[Примітка. pH цього розчину становить від 2,4 до 2,6.]
Розчин для перевірки придатності системи. Перемістіть приблизно 10 мг гемцитабіну гідрохлориду в невеликий флакон, додайте 4 мл розчину, що містить 168 мг гідроксиду калію на мл метанолу, щільно закрийте кришкою та обробіть ультразвуком.Нагрійте при 55°С протягом 6-16 годин, дайте охолонути та перенесіть вміст у 100-мл мірну колбу з послідовними промиваннями 1% (об./об.) фосфорної кислоти.Розведіть 1% фосфорною кислотою до об’єму і перемішайте.[Примітка. Цей розчин містить приблизно 0,02 мг на мл α-аномера гемцитабіну.]
Стандартна підготовка. Розчиніть точну зважену кількість USP гемцитабіну гідрохлориду RS у воді та кількісно та поетапно, якщо необхідно, розбавте водою, щоб отримати розчин із відомою концентрацією приблизно 0,1 мг на мл.
Підготовка до аналізу. Перенесіть близько 20 мг гемцитабіну гідрохлориду, точно зважених, у 200-мл мірну колбу, розчиніть і розведіть водою до об’єму та перемішайте.
Хроматографічна система (див. Хроматографія <621>) - Рідинний хроматограф оснащений 275-нм детектором і колонкою 4,6 мм × 25 см, яка містить 5-мкм насадку L7.Швидкість потоку становить близько 1,2 мл на хвилину.Хроматографуйте розчин для перевірки придатності системи та зафіксуйте пікові відповіді, як зазначено в Процедурі: роздільна здатність, R, між -аномером гемцитабіну та гемцитабіном становить не менше 8,0;і коефіцієнт хвоста, визначений для гемцитабіну, не перевищує 1,5.Хроматографуйте стандартний препарат і запишіть пікові відповіді відповідно до вказівок для процедури: відносне стандартне відхилення для повторних ін’єкцій становить не більше 1,0%.
Процедура. Окремо введіть рівні об’єми (приблизно 20 мкл) стандартного препарату та препарату для аналізу в хроматограф, запишіть хроматограми та виміряйте відповіді для основних піків.Обчисліть кількість, мг, C9H11F2N3O4·HCl у частці гемцитабіну гідрохлориду за формулою:
200C(rU / rS)
де С — концентрація гемцитабіну гідрохлориду RS у стандартному препараті, у мг на мл;і rU та rS – пікові відповіді, отримані від препарату для аналізу та стандартного препарату відповідно.
-

Гемцитабіну гідрохлорид CAS 122111-03-9 API U...
-

Гемцитабін CAS 95058-81-4 Аналіз 98,0~102,0%
-

Цефотіам гідрохлорид CAS 66309-69-1 API USP S...
-

Доксорубіцину гідрохлорид CAS 25316-40-9 API США...
-

Еналаприл малеат CAS 76095-16-4 Аналіз 98,0~102...
-

Гуанфацин гідрохлорид Гуанфацин HCl CAS 291...
-

Іринотекан гідрохлорид CAS 100286-90-6 Чистота...
-

Levetiracetam LEV CAS 102767-28-2 API Factory U...
-

Налтрексону гідрохлорид CAS 16676-29-2 API USP...
-

Гідрат носкапіну гідрохлориду CAS 912-60-7 AP...
-

Леводопа (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Дарунавір CAS 206361-99-1 Чистота проти ВІЛ ≥99,0...
-

Езетиміб CAS 163222-33-1 Чистота 98,5% ~ 102,0% (...
-

Лазофоксифен тартрат CAS 190791-29-8 Хіральний пу...
-

Бортезоміб CAS 179324-69-7 Чистота ≥99,0% (ВЕРХ)...
-

CAS 274901-16-5 Чистота ≥99,0% (ВЕРХ) API