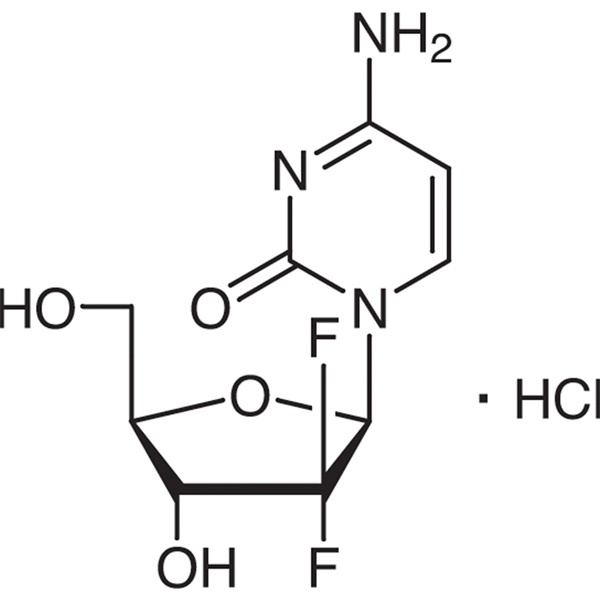
Gemcitabine Hydrochloride CAS 122111-03-9 Tiêu chuẩn API USP35
Ruifu Chemical là nhà sản xuất hàng đầu của Gemcitabine Hydrochloride (CAS: 122111-03-9) với chất lượng cao, sản xuất thương mại.Ruifu Chemical có thể cung cấp giao hàng trên toàn thế giới, giá cả cạnh tranh, dịch vụ xuất sắc, số lượng nhỏ và số lượng lớn có sẵn.Mua Gemcitabine Hydrochloride,Please contact: alvin@ruifuchem.com
| Tên hóa học | Gemcitabine Hydrochloride |
| từ đồng nghĩa | Gemcitabin HCl;2'-Deoxy-2',2'-Difluorocytidine Hydrochloride;dFdC;dFdCyd;đá quý;LY188011 Hiđrôclorua;đá quý;đá quý |
| Số CAS | 122111-03-9 |
| CAS liên quan | 95058-81-4 - Cơ sở miễn phí |
| Tình trạng tồn kho | Còn hàng, năng lực sản xuất 5 tấn |
| Công thức phân tử | C9H12ClF2N3O4 |
| trọng lượng phân tử | 299.66 |
| Độ nóng chảy | >250℃ |
| Điều kiện vận chuyển | Dưới nhiệt độ môi trường xung quanh |
| COA & MSDS | Có sẵn |
| Nguồn gốc | Thượng Hải, Trung Quốc |
| Thương hiệu | Hóa chất Ruifu |
| Mục | thông số kỹ thuật | Kết quả |
| Vẻ bề ngoài | Bột kết tinh màu trắng, không mùi | tuân thủ |
| độ hòa tan | Hòa tan trong nước, ít tan trong metanol, thực tế không hòa tan trong acetone | tuân thủ |
| Nhận dạng IR | Phổ hồng ngoại phải phù hợp với của tiêu chuẩn tham chiếu | tuân thủ |
| Nhận dạng Clorua | Tích cực.Nó đáp ứng các yêu cầu của các thử nghiệm đối với clorua | tuân thủ |
| Sự xuất hiện của giải pháp | Giải pháp S rõ ràng và không mãnh liệt hơn có màu hơn so với dung dịch tham chiếu BY7 | tuân thủ |
| pH | 2.0~3.0 | 2.6 |
| Vòng quay cụ thể [α]20/D | +43,0° đến +50,0° | +47,5° |
| Kim loại nặng (Pb) | ≤10ppm | <10ppm |
| Tổn thất khi sấy khô | ≤1,00% | 0,3% |
| Dư lượng đánh lửa | ≤0,10% | 0,03% |
| Những chất liên quan | ||
| Cytosine | ≤0,10% | 0,01% |
| đồng phân α | ≤0,10% | 0,01% |
| Bất kỳ tạp chất nào khác | ≤0,10% | 0,04% |
| Tổng tạp chất | ≤0,20% | 0,1% |
| dung môi dư | ||
| metanol | ≤0,30% | Không được phát hiện |
| toluen | ≤0,01% | Không được phát hiện |
| điclometan | ≤0,01% | Không được phát hiện |
| axeton | ≤0,50% | 0,1% |
| xét nghiệm | 97,5%~101,5% (Tính trên Cơ sở khô) | 99,9% |
| Phần kết luận | Phù hợp với tiêu chuẩn USP35 | |
Bưu kiện:Chai, túi giấy nhôm, 25kg / Thùng các tông, hoặc theo yêu cầu của khách hàng.
Điều kiện bảo quản:Đậy kín hộp chứa và bảo quản trong kho khô ráo, thoáng mát, tránh xa các chất không tương thích.Tránh tiếp xúc với ánh sáng mặt trời trực tiếp, độ ẩm và nhiệt độ quá cao.
Đang chuyển hàng:Giao hàng trên toàn thế giới bằng đường hàng không, bằng FedEx / DHL Express.Cung cấp giao hàng nhanh chóng và đáng tin cậy.


Mã rủi ro R21 - Có hại khi tiếp xúc với da
R36/38 - Gây kích ứng da và mắt.
R46 - Có thể gây tổn thương gen di truyền
R62 - Có thể có nguy cơ suy giảm khả năng sinh sản
R63 - Nguy cơ có thể gây hại cho thai nhi
Mô tả an toàn S25 - Tránh tiếp xúc với mắt.
S26 - Trong trường hợp tiếp xúc với mắt, ngay lập tức rửa sạch bằng nhiều nước và tìm tư vấn y tế.
S36/37 - Mặc quần áo và găng tay bảo hộ phù hợp.
S53 - Tránh phơi nhiễm - xin hướng dẫn đặc biệt trước khi sử dụng.
WGK Đức 3
RTECS HA3840000
Mã HS 2942000000
Gemcitabine Hydrochloride (CAS: 122111-03-9) là một loại thuốc difluoro nucleoside mới tổng hợp có tác dụng chống chuyển hóa và chống ung thư.Nó được nghiên cứu và phát triển bởi Eli Lilly and Company và được phê duyệt để niêm yết ở Nam Phi, Thụy Điển, Hà Lan, Úc và các quốc gia khác vào năm 1995. Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt nó như là liệu pháp đầu tay để điều trị lâm sàng ung thư phổi không phải tế bào nhỏ và ung thư tuyến tụy.
Những năm gần đây, các loại thuốc mới như Gemcitabine, Paclitaxel, Docetaxel, Vinorebine là những thuốc hiệu quả trong điều trị ung thư phổi không tế bào nhỏ (viết tắt NSCLC).So với các loại thuốc hóa trị liệu truyền thống, những loại thuốc này có ưu điểm là hiệu quả chữa bệnh cao và độc tính thấp.Gemcitabine Hydrochloride là thuốc chống chuyển hóa thế hệ mới và là loại thuốc đặc trị cho chu kỳ tế bào, đóng vai trò chính trong pha tổng hợp DNA, là pha S của tế bào.Trong một số điều kiện nhất định, thuốc này có thể ngăn chặn sự phát triển của các tế bào từ pha G1 sang pha S và có hoạt tính chống ung thư mạnh ung thư phổi không phải tế bào nhỏ (NSCLC).Các nghiên cứu nước ngoài đã chỉ ra rằng hiệu quả của phương pháp điều trị đơn lẻ đối với NSCLC chỉ bằng Gemcitabine Hydrochloride là khoảng 18% ~ 35%, trong khi kết hợp điều trị với cisplatin thì hiệu quả đối với NSCLC là 41,7%.Trong NSCLC tiên tiến, tỷ lệ hiệu quả của carboplatin là 16%, tương tự như cisplatin, nhưng độc tính thấp, đặc biệt đối với các phản ứng tiêu hóa, ức chế tủy xương và phản ứng độc hại của thận và đầu dây thần kinh.Khi kết hợp với carboplatin, cả hai đều có tác dụng phối hợp và cộng hưởng lẫn nhau, có thể tạo ra hiệu quả chữa bệnh cao hơn.
Gemcitabine Hydrochloride
C9H11F2N3O4·HCl 299,66
Cytidine, 2′-deoxy-2′,2′-difluro-, monohydrochloride.
2′-Deoxy-2′,2′-difluorocytidine monohydrochloride (-đồng phân β) [122111-03-9].
» Gemcitabine Hydrochloride chứa không ít hơn 97,5 phần trăm và không nhiều hơn 101,5 phần trăm C9H11F2N3O4·HCl, được tính trên cơ sở nguyên trạng.
[Thận trọng-Gemcitabine Hydrochloride là một tác nhân gây độc tế bào mạnh.Cần hết sức cẩn thận để tránh hít phải các hạt và để da tiếp xúc với chúng.]
Bao gói và bảo quản - Bảo quản trong bao bì kín.
Ghi nhãn-Trường hợp nó được dự định sử dụng để pha chế các dạng thuốc tiêm, nhãn ghi rằng nó vô trùng hoặc phải được xử lý thêm trong quá trình pha chế các dạng thuốc tiêm.
Tiêu chuẩn tham khảo USP <11>-
USP Cytosine RS
Nội độc tố USP RS
USP Gemcitabine Hydrochloride RS
Nhận biết-
A: Hấp thụ tia hồng ngoại <197K>.
B: Nó đáp ứng các yêu cầu của các thử nghiệm đối với Clorua <191>.
Vòng quay cụ thể <781S>: giữa +43 và +50, ở mức 20.
Dung dịch thử: 10 mg mỗi mL.
pH <791>: giữa 2,0 và 3,0, trong dung dịch chứa 10 mg mỗi mL.
Cặn khi đánh lửa <281>: không quá 0,1%.
Kim loại nặng, Phương pháp I <231>: 0,001%.
Độ tinh khiết sắc ký-
Giải pháp A- Tiến hành theo chỉ dẫn đối với Pha động trong Xét nghiệm.
Dung dịch B-Chuẩn bị metanol đã lọc và khử khí.
Pha động-Sử dụng các hỗn hợp khác nhau của Dung dịch A và Dung dịch B theo hướng dẫn trong hệ thống sắc ký.Thực hiện các điều chỉnh, nếu cần (xem Tính phù hợp của Hệ thống trong Sắc ký 621).
Giải pháp phù hợp với hệ thống-Tiến hành theo chỉ dẫn trong Xét nghiệm.
Dung dịch chuẩn-Hòa tan một lượng USP Gemcitabine Hydrochloride RS và USP Cytosine RS được cân chính xác trong nước, pha loãng định lượng và pha loãng từng bước nếu cần, để thu được dung dịch có nồng độ đã biết khoảng 2 µg trên mỗi mL của mỗi loại.
Dung dịch thử - Cân chính xác khoảng 50 mg Gemcitabine Hydrochloride, cho vào bình định mức 25 mL, hòa tan và pha loãng bằng nước đến vạch mức, trộn đều.
Hệ thống sắc ký (xem Sắc ký 621)-Tiến hành theo hướng dẫn trong Xét nghiệm.Máy sắc ký được lập trình như sau.
Thời gian (phút) Dung dịch A (%) Dung dịch B (%) Dung dịch rửa giải
0–8 97 3 chuyên chế
Độ dốc tuyến tính 8–13 97®50 3®50
13–20 50 50 chuyên quyền
20–25 50®97 50®3 tái cân bằng
Sắc ký dung dịch phù hợp của Hệ thống và ghi lại các phản ứng cực đại theo hướng dẫn cho Quy trình: thời gian lưu tương đối là khoảng 0,5 đối với gemcitabine -anomer và 1,0 đối với gemcitabine;độ phân giải, R, giữa gemcitabine -anomer và gemcitabine không nhỏ hơn 8,0;và hệ số đuôi của gemcitabine không quá 1,5.Sắc ký dung dịch Chuẩn và ghi lại các phản ứng cực đại theo hướng dẫn cho Quy trình: thời gian lưu tương đối là khoảng 0,1 đối với cytosine và 1,0 đối với gemcitabine;độ lệch chuẩn tương đối đối với các lần tiêm lặp lại không quá 2,0%.
Quy trình - Bơm riêng một thể tích (khoảng 20 µL) dung dịch Chuẩn và dung dịch Thử vào máy sắc ký, ghi lại sắc ký đồ và đo tất cả các đáp ứng pic.Tính tỷ lệ phần trăm của cytosine trong phần Gemcitabine được lấy theo công thức:
2.5(Cc / W)(rt / rs)
trong đó Cc là nồng độ của USP Cytosine RS trong dung dịch Chuẩn, tính bằng µg trên mL;W là khối lượng Gemcitabin đã uống, tính bằng mg;rt là phản ứng đỉnh đối với cytosine trong dung dịch Thử nghiệm;và rs là phản ứng đối với cytosine trong dung dịch Chuẩn: không quá 0,1% cytosine được tìm thấy.Tính tỷ lệ phần trăm của mỗi tạp chất không phải là cytosine trong phần Gemcitabine đã lấy theo công thức:
2,5(Cs / W)(ri / rs)
trong đó Cs là nồng độ của USP Gemcitabine Hydrochloride RS trong dung dịch Chuẩn, tính bằng μg trên mL;W là khối lượng Gemcitabin đã uống, tính bằng mg;ri là phản ứng cực đại đối với từng tạp chất trong dung dịch Thử nghiệm;và rs là phản ứng do gemcitabine trong dung dịch Chuẩn: không quá 0,1% đồng phân gemcitabine hoặc bất kỳ tạp chất riêng lẻ nào khác được tìm thấy;và tổng của tất cả các tạp chất không quá 0,2%.Loại trừ khỏi tổng tất cả các tạp chất bất kỳ pic nào nằm dưới giới hạn định lượng (0,02%).
Các yêu cầu khác-Trường hợp nhãn ghi rằng Gemcitabine Hydrochloride là vô trùng, nó đáp ứng các yêu cầu về Nội độc tố vi khuẩn và Tính vô trùng đối với Gemcitabine dùng để tiêm.Khi nhãn ghi rằng Gemcitabine Hydrochloride phải được xử lý thêm trong quá trình bào chế dạng bào chế thuốc tiêm, thì nhãn đó đáp ứng các yêu cầu đối với nội độc tố vi khuẩn trong Gemcitabine dùng để tiêm.
xét nghiệm-
Pha động-Chuẩn bị dung dịch đã lọc và khử khí chứa 13,8 g natri photphat đơn bazơ và 2,5 mL axit photphoric trong 1000 mL nước.[lưu ý-Độ pH của dung dịch này nằm trong khoảng từ 2,4 đến 2,6.]
Giải pháp phù hợp với hệ thống-Chuyển khoảng 10 mg Gemcitabine Hydrochloride vào một lọ nhỏ, thêm 4 mL dung dịch chứa 168 mg kali hydroxit trên mỗi mL metanol, đậy chặt nắp và siêu âm.Đun nóng ở 55oC trong 6 đến 16 giờ, để nguội và chuyển lượng chứa vào bình định mức 100 mL với các lần rửa liên tiếp bằng axit photphoric 1% (v/v).Pha loãng bằng axit photphoric 1% đến vạch và trộn.[lưu ý-Dung dịch này chứa khoảng 0,02 mg mỗi mL gemcitabine α-anomer.]
Chuẩn bị tiêu chuẩn-Hòa tan một lượng USP Gemcitabine Hydrochloride RS được cân chính xác trong nước và pha loãng định lượng, và pha loãng từng bước nếu cần, với nước để thu được dung dịch có nồng độ đã biết khoảng 0,1 mg trên mL.
Chuẩn bị xét nghiệm-Chuyển khoảng 20 mg Gemcitabine Hydrochloride, đã cân chính xác, vào bình định mức 200 mL, hòa tan và pha loãng với nước đến vạch mức, trộn đều.
Hệ thống sắc ký (xem Sắc ký <621>)-Máy sắc ký lỏng được trang bị đầu dò 275-nm và cột 4,6-mm x 25-cm chứa L7 đóng gói 5-µm.Tốc độ dòng chảy khoảng 1,2 mL mỗi phút.Sắc ký dung dịch phù hợp của Hệ thống, và ghi lại các phản ứng cực đại theo hướng dẫn cho Quy trình: độ phân giải, R, giữa đồng phân gemcitabine và gemcitabine không nhỏ hơn 8,0;và hệ số đuôi được xác định từ gemcitabine không quá 1,5.Sắc ký phần Chuẩn bị chuẩn và ghi lại các phản ứng cực đại theo hướng dẫn cho Quy trình: độ lệch chuẩn tương đối đối với các lần tiêm lặp lại không quá 1,0%.
Quy trình-Tiêm riêng biệt các thể tích bằng nhau (khoảng 20 µL) của Chuẩn bị chuẩn và Chuẩn bị xét nghiệm vào máy sắc ký, ghi lại sắc ký đồ và đo phản ứng đối với các pic chính.Tính lượng, tính bằng mg, của C9H11F2N3O4·HCl trong phần Gemcitabine Hydrochloride được lấy theo công thức:
200C(rU/rS)
trong đó C là nồng độ, tính bằng mg trên mL, của USP Gemcitabine Hydrochloride RS trong chế phẩm Chuẩn;và rU và rS lần lượt là các phản ứng cực đại thu được từ quá trình chuẩn bị Xét nghiệm và chuẩn bị Tiêu chuẩn.
-

Gemcitabine Hydrochloride CAS 122111-03-9 API U...
-

Xét nghiệm Gemcitabine CAS 95058-81-4 98,0~102,0%
-

Cefotiam Hydrochloride CAS 66309-69-1 API USP S...
-

Doxorubicin Hydrochloride CAS 25316-40-9 API Hoa Kỳ...
-

Enalapril Maleate CAS 76095-16-4 Xét nghiệm 98,0~102...
-

Guanfacine Hydrochloride Guanfacine HCl CAS 291...
-

Irinotecan Hydrochloride CAS 100286-90-6 Độ tinh khiết...
-

Nhà máy API Levetiracetam LEV CAS 102767-28-2 U...
-

Naltrexone Hydrochloride CAS 16676-29-2 API USP...
-

Noscapine Hydrochloride Hydrat CAS 912-60-7 AP...
-

Levodopa (L-DOPA) CAS 59-92-7 99,0~100,5% USP B...
-

Darunavir CAS 206361-99-1 Độ tinh khiết chống HIV ≥99,0...
-

Ezetimibe CAS 163222-33-1 Độ tinh khiết 98,5% ~ 102,0% (...
-

Lasofoxifene Tartrate CAS 190791-29-8 Chirus Pu...
-

Bortezomib CAS 179324-69-7 Độ tinh khiết ≥99,0% (HPLC)...
-

CAS 274901-16-5 Độ tinh khiết ≥99,0% (HPLC) API